《物理化学》章末总结14
十四章为本书最后一章,讨论胶体系统和大分子溶液。
第十四章 胶体分散系统和大分子溶液
把一种或几种物质分散在另一种物质中就构成分散系统,在分散系统中被分散的物质叫分散相(dispersed phase),另一种物质叫分散介质(dispersion medium)。例如氯化钠溶液中的氯化钠就是分散相,水则是分散介质。
按照分散相粒子的大小可以将分散系统分类,分为分子分散系统($r < 1 \rm nm$)、胶体分散系统($1 \rm nm \leq r \le 100 \rm nm$)和粗分散系统($r > 100 \rm nm$)。
胶体分散系统为多相系统,因此和上一章的表面物理化学有不少联系,同时也有自己独特的性质和应用,胶体分散系统的研究得到了迅速的发展,已经成为一门独立的学科。
14.1 胶体和胶体的基本特性
1861年,Graham在研究物质在水中的扩散时,把各种物质分为晶体(crystal)和胶体(colloid)两类,尽管这一分类并不正确,但是他是首先认识到物质的胶体性质的人。
后来的一些学者发现任何典型的晶体物质都可以用降低溶解度或选用适当分散介质而制成溶胶,因此人们认识到胶体只是物质以一定分散程度而存在的一种状态,而不是一种特殊类型的物质的固有状态。
人们发现胶体系统至少包含性质颇不相同的两大类:一是难溶物分散在分散介质中所形成的憎液溶胶(lyophobic),简称溶胶。一是大分子化合物的溶液。
溶胶具有很大的相界面,很高的表面自由能,易被破坏而聚沉(coagulation),聚沉后不能恢复,是一个热力学不稳定、不可逆的系统。
大分子溶液具有胶体的一些特性,如丁达尔效应,但是它是分子分散的真溶液,是热力学稳定、可逆的系统。
任何溶胶粒子的表面上总是带有电荷,例如以$AgNO_3$的稀溶液和$KI$的稀溶液反应生成$AgI$为例,反应生成的碘化银是非常小的不溶性粒子,称为胶核(colloidal nucleus)。
胶核会吸附溶液中过量的同种粒子,例如制备$AgI$时$KI$过剩,则$I^-$在胶核表面上优先被吸附。在表面吸附后,周围的反号离子又会吸附到附加的吸附层中,称为胶粒(colloidal particle)。胶粒连同介质和相反电荷离子一并构成胶团(或称胶束,micelle)。可见下图。
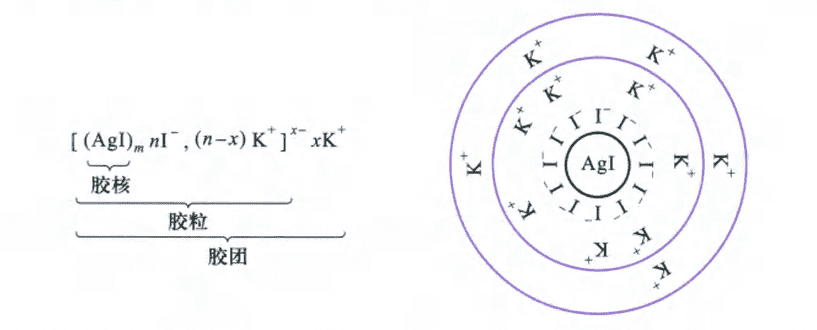
在溶胶中胶粒是独立运动单位,通常所说的“溶胶带电荷”指的就是胶粒的电性,整个胶团是不带电的。
14.2 溶胶的制备和净化
溶胶的制备需要使分散相粒子的大小落在胶体分散系统的范围内,同时也需要有适当的稳定剂存在。
溶胶制备方法包括分散法(dispersing method)和凝聚法(condensation method)两大类。分散法又包括研磨法、胶溶法、超声波分散法、电弧法、气相沉积法等。凝聚法包括化学凝聚法、物理凝聚法、更换溶剂法等。其具体细节不多介绍。
制得的溶胶中常含有一些电解质,可能会破环溶胶的稳定性,因此需要净化溶胶。常用方法包括渗析法(dialysis method)、超过滤法(ultrafiltration method)等。
14.3 溶胶的动力性质
动力性质(dynamic properties)主要指溶胶中粒子的不规则运动和由此而产生的扩散、渗透压,在重力场下浓度随高度的分布平衡等性质。
微粒的不规则运动即为Brown运动,其本质是不断热运动的液体分子对粒子冲击的结果,Brown运动平均位移的公式由Einstein给出:
$$
\overline {x^2} = \frac {RT}{L} \cdot \frac {t}{3\pi \eta r}
$$
式中$\overline x$是粒子运动平均位移,$r$为粒子半径,$\eta$为介质粘度,$L$为Avogadro常数,此式也成为Einstein-Brown运动公式。
在一个较大的体积范围内,胶体粒子的分布是均匀的,但如果观察一个有限的小体积元会发现,由于粒子的Brown运动,小体积内粒子的数目有时较多,有时较少,这种粒子数的变动现象称为涨落现象(fluctuation)。
胶粒远比普通分子大,且不稳定,因此扩散作用和渗压表现不显著,但是仍具有这些性质。其扩散作用和渗透压的表示同一般稀溶液一致。
溶胶粒子受到重力作用会慢慢地下降,另一方面Brown运动又促使浓度趋向均一,因此两种效应最终会使得粒子分布达到平衡,形成一种浓度梯度,称为沉降平衡(sedimentation equilibrium)。
粒子的高度分布满足下式:
$$
\frac {N_1}{N_2} = \exp \left[-\frac 43 \pi r^3 (\rho_{粒子}-\rho_{介质})gL(x_2 - x_1)\frac {1}{RT} \right]
$$
溶胶的胶粒能够自动扩散,并使整个系统均匀分布,许多溶胶可以静置维持几年以上依然不会沉降下来,这种性质称为动力稳定性(dynamic stability)。
14.4 溶胶的光学性质
溶胶的光学性质是其高度分散性和不均匀性特点的反映,如Tyndall效应和Rayleigh公式。
Tyndall效应我们在高中学习中就已经很熟悉了,光束在通过胶体时,我们能够看到一条明显的光路。其实Tyndale效应还有另一个特点,即当光通过分散系统时,在不同方向观察光柱有不同的颜色,在垂直方向观察,由于光的散射,往往会呈现浅蓝色,也称Tyndall blue,可见下图(网图)。

提到散射,就不得不说Rayleigh散射了,一些胶粒对光的散射也符合Rayleigh散射公式:
$$
I = \frac {24\pi^2 A^2 \nu V^2}{\lambda^4} \left(\frac {n_1^2 - n_2^2}{n_1^2+2n_2^2} \right)^2
$$
它适用于不导电且粒子半径$\le 47 \rm nm$的系统。对于更大粒径的粒子及大分子化合物,其散射需要用Mie散射理论或Debye散射理论研究,此处略。
14.5 溶胶的电学性质
在液-固界面处,固体表面上与其附近的液体内通常会分别带有电性相反、电荷量相同的两层离子,从而形成双电层。这种固体表面的带电荷离子称为定位离子(localized ion)。
固体表面上产生定位离子的原因,可归结为几个方面:吸附、解离、同晶置换、溶解量不均衡等。在外电场作用下,带电荷粒子将发生运动,这就是分散系统的电动现象(electrokinetic phenomenon)。
接下来介绍几种典型的电动现象。
在外电场的作用下带有电荷的溶胶粒子作定向的迁移,称为电泳(electrophoresis)。其本质上和电解质溶液中带电荷离子在外电场的作用下定向迁移是一样的。
影响电泳的因素有:带电荷粒子的大小、性质,粒子表面的电荷数目,溶剂中电解质的种类、离子强度,以及pH、温度和所加的电压等。
在外加电场下,可以观察到分散介质会通过多孔性物质而移动,即固相不动而液相移动,这种现象称为电渗(electroosmosis)。
电渗和电泳的区别在于电泳是带电粒子作定向迁移,电渗则是固体和液体之间的双电层中的离子带动分散介质一起运动。
电泳和电渗都非常重要,在实际生产中有许多重要应用。
在外力作用下,分散相粒子在分散介质中迅速沉降,则在液体介质的表面层和内层之间产生电势差,称为沉降电势(sedimentation potential)。在外力作用下,使液体经毛细管或多孔塞时,液体介质相对于静止带电荷表面流动而产生的电势差,称为流动电势(streaming potential)。这两种电势研究方法复杂,相对研究得较少。
14.6 双电层理论和ζ电势
直到双电层理论提出后,人们才真正理解了产生电动现象的原因。当固体与液体接触时,可以是固体从溶液中选择性吸附某种离子,也可以是由于固体分子本身的解离作用使离子进入溶液,以致固、液两相分别带有不同符号的电荷,在界面上形成了双电层结构。
Helmholtz首先提出平板双电层模型,认为带电荷质点的表面电荷与相反电荷的离子构成平行的两层,即双电层(electric double layer)。见下图(a)。
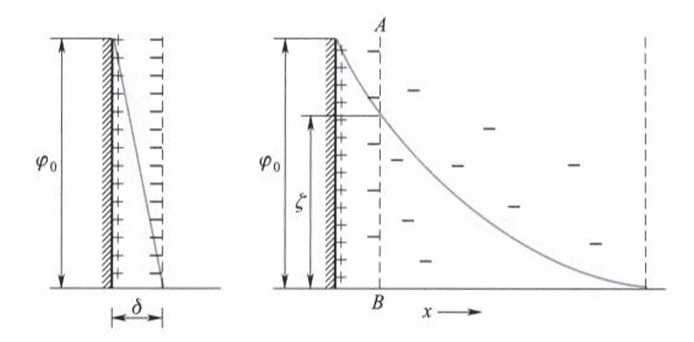
然而,这个模型虽然给了电动现象一个说明,但是忽略了离子的热运动,实际上双电层不可能是一个完整的平板电容器模型。
Gouy和Chapman修正了该模型,提出了扩散双电层的模型,见上图(b)。他们认为电荷离子的排布是静电吸引和热运动两种效应的综合结果,反号离子只有一部分紧密排列在固体表面上,另一部分离子与固体表面的距离则可以从紧密层一直分散到本体溶液中。
这就把双电层分成了紧密层和扩散层两个部分,在电场作用下,仅有扩散层的离子才能够发生电动现象,这种相对运动边界处与溶液本体之间的电势差称为电动电势(electrokinetic potential)或$\zeta$电势。
Gouy-Chapman模型虽然克服了Helmholtz模型的缺陷,但也有许多不能解释的实验事实。例如他们实际上不能为$\zeta$电势赋予更明确的物理意义,同时也难以解释$\zeta$电势在实验中根据实验条件不同而发生的变化。
后来,又有Stern模型、Essin-Markov模型、Bockris-Devanathan-Muller模型等,目前关于双电层的理论还未发展到尽善尽美的程度,仍需要不断地充实。
14.7 溶胶的稳定性和聚沉作用
前面提到,溶胶是热力学不稳定系统,因为其表面能高,粒子有聚沉而降低表面能的趋势。另一方面,胶粒粒子的Brown运动剧烈,在重力场中不易沉降,具有动力学稳定性,但是这种稳定性一旦被打破,粒子就会快速聚结,使得Brown运动速率减小,最终成为动力不稳定的系统。
粒子聚集由小变大的过程称为聚集过程(aggregation)。如果聚集的最终结果是粒子从溶液中沉淀析出,则称为聚沉过程(coagulation)。
为加速聚沉,可以外加某些物质作为聚沉剂(coagulant),或者使用某些物理因素,如光、电、热等使溶胶聚沉。
溶胶对电解质的影响非常敏感,通常用聚沉值(coagulation value)来表示电解质的聚沉能力,聚沉值是指使一定量的溶胶在一定时间内完全聚沉所需电解质的最小浓度。
换句话说,聚沉值越小,表明该电解质的聚沉能力越强。
电解质的聚沉能力主要取决于与溶胶粒子带相反电荷的粒子的价数,电荷数越大,则聚沉能力越强。聚沉值与异电性离子价数的六次方成反比,称为Schulze-Hardy规则。
相同价数的离子聚沉能力也各有不同,例如不同一价阴离子所形成的钾盐,对带正电荷的$Fe_2O_3$溶胶的聚沉能力则有如下次序:
$$
F^- > Cl^- > Br^- > NO_3^- > I^-
$$
这一次序称为感胶离子序(lyotropic series),它与水合离子半径从小到大的次序大致相同。
胶体的稳定性问题是胶体化学中的一个重要研究课题,在20世纪40年代,苏联学者Deryagi和Landau与荷兰学者Verwey和Overbeek分别提出了粒子的吸引能和双电层排斥能的计算方法,并称DLVO理论(取他们姓名的首字母)。
以水为介质的DLVO理论的一种简化表示式为:
$$
c = K \cdot \frac {\gamma^4}{A^2z^6}
$$
对某种溶胶而言,$A$和$\gamma$有定值,所以从理论上验证了Schulze-Hardy规则。
14.8 乳状液
乳状液(emulsion)是由两种液体所构成的分散系统,是由一种液体以极小的液滴形式分散在另一种与其不相溶的液体中所构成的。
乳状液可以分为水包油乳状液(oil in water emulsionn, O/W)和油包水乳状液(water in oil emulsion, W/O)两种。无论是哪种乳状液的形成,都需要乳化剂(emulsifying agent)的存在,乳化剂的作用在于使机械分散所得液珠不相互聚结。
乳状液是热力学不稳定系统,容易发生分层(分成两层乳状液)、变型(即O/W型和W/O型的转变)和破乳(分成两种独立液体)。
14.9 凝胶
凝胶(gel)是固-液或固-气所形成的一种分散系统,其中分散相粒子相互连接成网状结构,分散介质填充于期间。
更多内容不详细介绍。
14.10 大分子溶液
根据Staudinger的定义,把相对分子质量大于$10^4$的物质称为大分子(macromolecule),由于其分子比较大,单个分子的大小就能达到胶体粒子大小的范围,并变现出胶体的一些性质。
大分子化合物中有天然的,如淀粉、蛋白质、核酸、纤维素、天然橡胶等等,也有人工合成的,如各种人工橡胶。
这部分内容在高分子化学中有更相近的介绍,此处略去。
14.11 Donnan平衡和聚电解质溶液的渗透压
聚电解质中常含有少量电解质杂质,电解质都是小离子,能自由通过半透膜,但当达到平衡时,小离子在膜两边分布不均等,这种平衡称为Donnan平衡。
考虑大分子电解质带有电荷,以蛋白质的钠盐为例:
$$
Na_zP \rightarrow zNa^+ + P^{z-}
$$
若不考虑其他电解质,蛋白质离子$p^{z-}$不能透过半透膜,而反离子$Na^+$可以透过。为保持电中性,$Na^+$和$P^{z-}$必须在膜的同一侧,因此粒子数增多引起渗透压增大。
$$
\Pi_2 = (z+1)c_2RT
$$
此时溶液的渗透压比大分子物质本身产生的渗透压大,如果据此求大分子摩尔质量,则结果偏小。
存在其他电解质时,情况更加复杂。如下图所示,图中(a)为膜平衡前离子浓度。
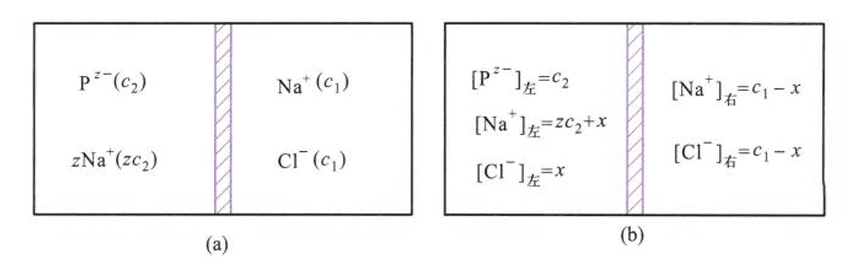
膜只允许$Na^+,Cl^-$通过,由于左侧没有氯离子,因此$Cl^-$从右侧到左侧,但为了维持电中性,$Na^+$也必须等量通过,最终达成膜平衡(membrane equilibrium),如上图(b)。
此时可以计算得出:
$$
\Pi_3 = \frac {zc_2^2+2c_1c_2+z^2c_2^2}{zc_2+2c_1}RT
$$
如果$c_1 \ll zc_2$,则可近似为:
$$
\Pi_3 \approx (c_2 + zc_2)RT = (z+1)c_2RT
$$
如果$c_1 \gg zc_2$,则:
$$
\Pi_3 \approx c_2RT
$$
14.12 流变学简介
本节为了解内容,此处略去。
( 这章太长了,我都写累了。= .= )
14.13 纳米粒子
纳米粒子通常是指尺寸在$1 \sim 100 \rm nm$的粒子,这样的系统具有一些独特的性质,不同于典型的微观或宏观系统,这种系统是介于二者之间的介观系统(mesoscopic system),其具有很多新颖的物理化学性质,如小尺寸效应、表面效应、量子尺寸效应和宏观量子隧道效应等。
具体内容本节略去。
总结
全书完结!
十四章讨论胶体和大分子溶液,内容很多很杂,我写的很简略,大概就是什么都有一点,但是什么都不深入。到也很正常了,毕竟这章学的时候讲地更简略。
写完十四章总结后回头看看,物理化学作为定量关系最明确,最“科学”的一门化学分支,无论是在课程教学,还是我的笔记总结中,都理应有更好的组织形式,还是有很大进步空间的。例如像国外Atkins等教材,或者浙大彭笑刚老师的《物理化学讲义》等书的设计思路就有很大不同,都是很值得借鉴的。当然看不完就是另一回事了(笑。