《有机合成-切断法》章末总结2
总结2讨论一下各羰基化合物的合成范式。
1 导论
本书用了整整十章来讨论各种羰基化合物的切断和合成,可见羰基转化在有机合成中的重要性。在正式开始讨论前先明确一些基本概念和整体上的思路。
许多化合物都含有羰基结构,如下图,这些化合物的官能团类型各自不同,但是有一点是相同的,那就是它们的位置关系,图中的三个化合物都可以看作1,3-二羰基化合物。
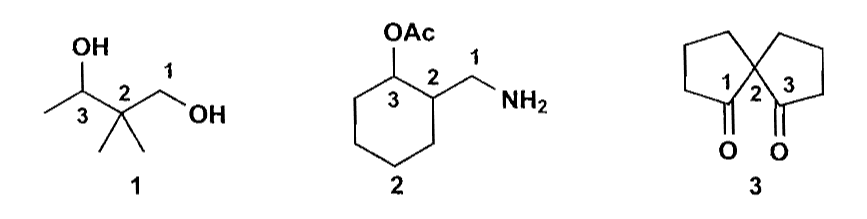
这一点给了我们一个思路:通过官能团转换,我们可以把这些都转化为羰基化合物,于是具有相同位置关系的化合物就可以用相同的方式来合成。我们在下文都将围绕这一思路来展开。
为了简便描述反应,我们在此将切断得到的合成子分一下类,将亲电性合成子用字母a(acceptor)表示,将亲核性合成子用字母d(donor)表示。并且在字母右上角表明亲电/亲核位点的编号(从羰基碳开始标号),因此常见的烯醇盐可以表示为$\bold d^2$,一般的醛酮则可以表示为$\bold a^1$。
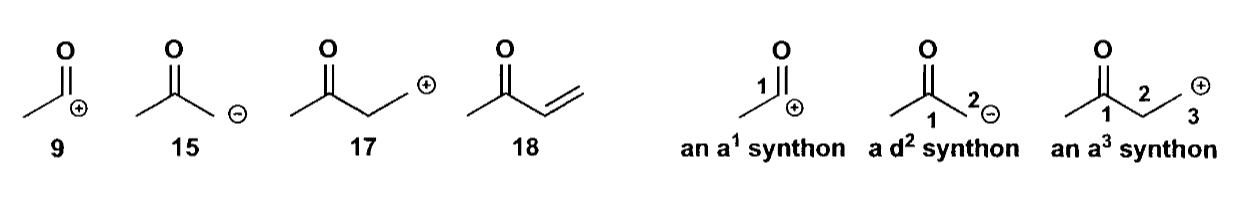
我们可以把常见的羟醛缩合反应描述为$\bold d^2$和$\bold a^1$合成子的反应,在倒推反应时,我们也可以根据$\bold d^2$和$\bold a^1$合成子来反推羟醛缩合反应。
我们总结常见的反应类似不难发现:奇数关系的二羰基化合物的反应极性是正常的(例如$\bold d^2 + \bold a^1$);偶数关系的二羰基化合物的反应是反常(例如$\bold d^1 + \bold a^1$)。这一点会决定我们的合成方式。
在发生缩合时,我们会用到各种各样的碱,考虑碱性的强弱能否攫氢得到需要的亲核试剂是很重要的,不同化合物和试剂的碱性比较见下表。
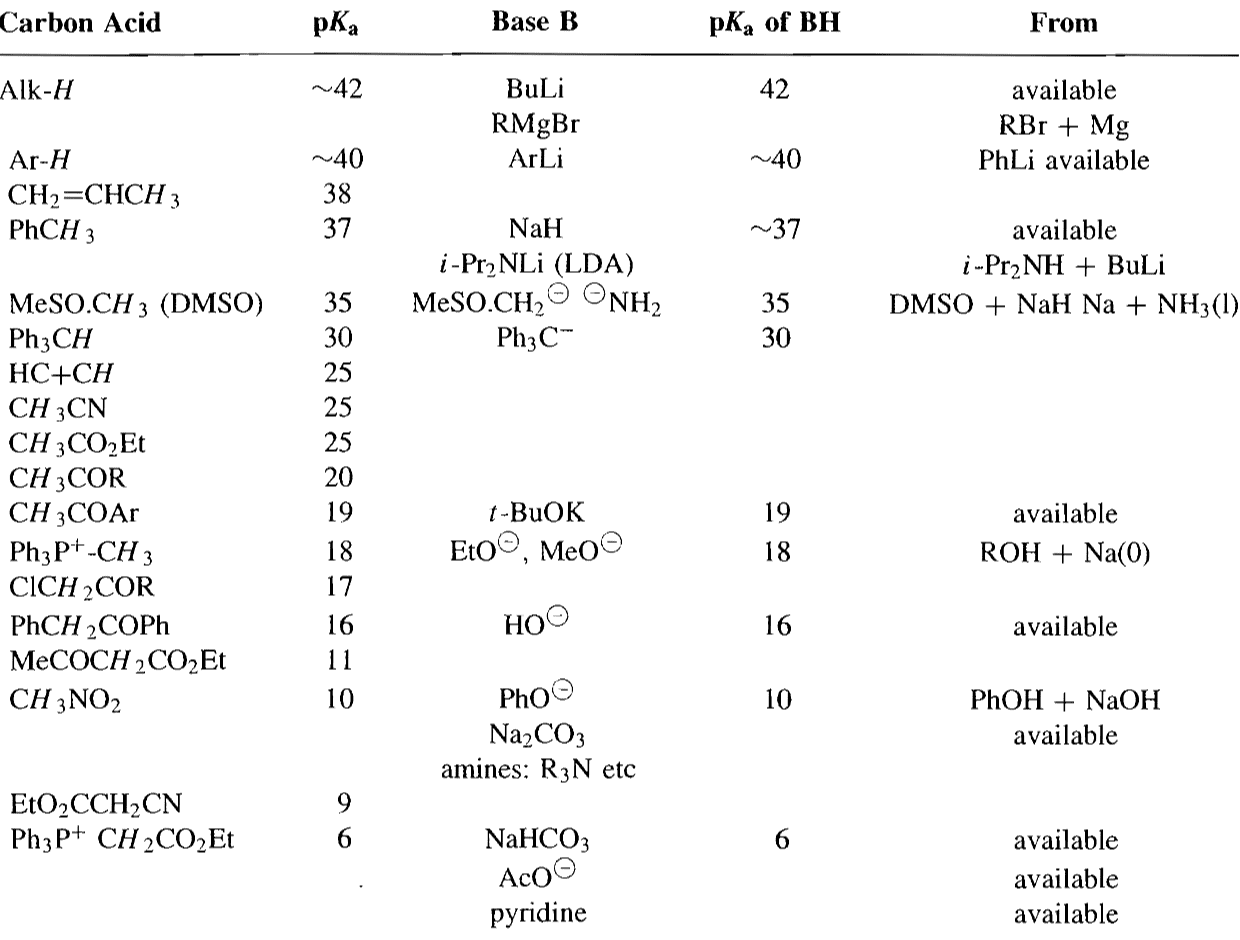
从表中发现,1,3-二羰基化合物的α-H酸性很强,用氢氧化钠或者醇钠就可以拔下来,但是一般的酮和酯的α-H酸性稍弱,需要让反应平衡移动才能很好的攫氢,而一些酸性更弱的物质则需要如氨基钠或氢化钠等更强的碱才能拔氢。
2 1,3-二官能团化合物
我们首先从1,3-二官能团化合物开始,因为这一反应类型是最常见的,羟醛缩合就是最典型的1,3-二官能团的合成反应。
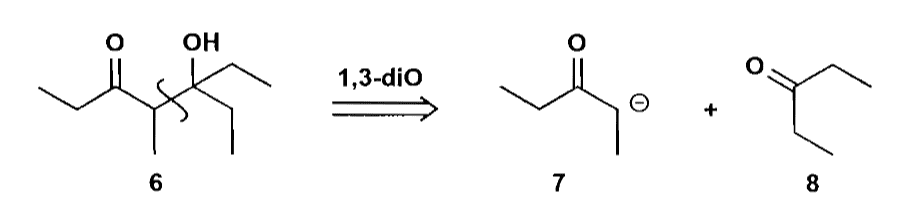
1,3-二官能团化合物的切断会给出$\bold d^2$合成子和$\bold a^1$合成子,反应的电性是正常的,但是选择性需要仔细考虑,实际上,羟醛缩合类的反应的主要难点就在于区域选择性的控制上。
交叉缩合反应有三个关键问题:(1)哪一个羰基化合物形成烯醇负离子?(2)对于不对称的酮,哪一侧形成烯醇?(3)哪一个羰基化合物充当亲电试剂?
这三个问题需要比较化合物的反应活性,下图是一个简易的比较:
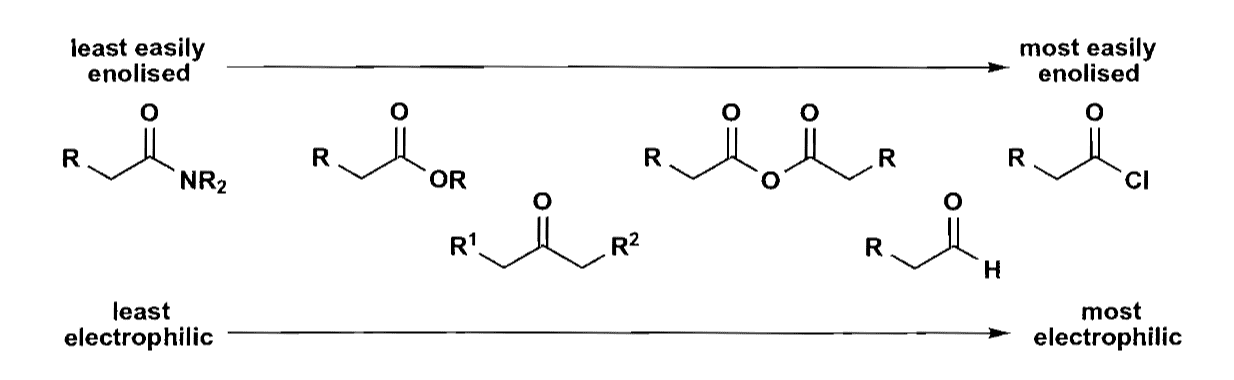
交叉缩合需要考虑如此多的问题,因此最好的方式就是尽量减少交叉缩合的使用,例如使用不能烯醇化的化合物,它们只能作为$\bold a^1$合成子而不能去进攻其他合成子。许多碳酸脂的衍生物都是很好的反应试剂。

还有苯甲醛或者其他无α-H的醛酮都可以减少交叉缩合的发生。
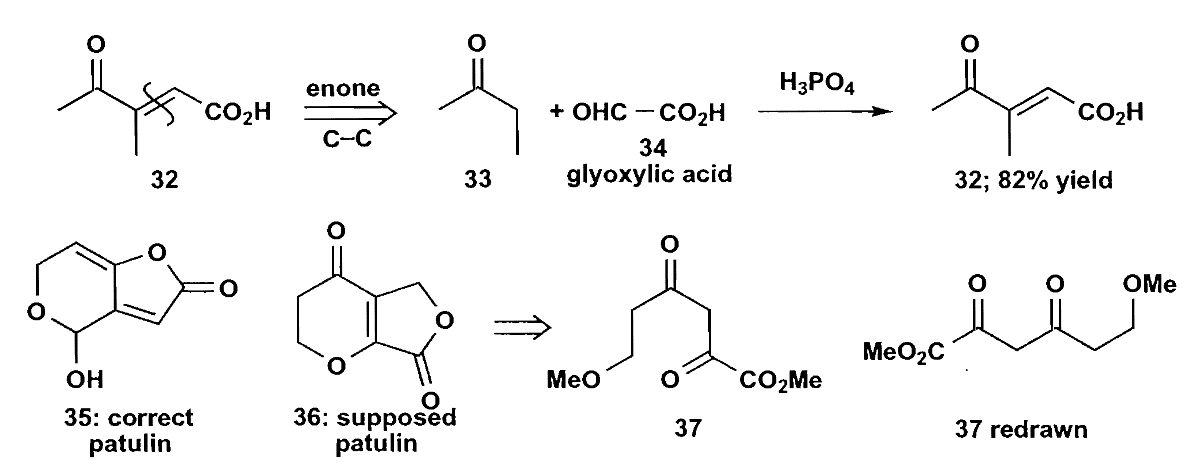
问题(1)(3)解决了,问题(2)仍需思考,对于不对称的$\bold d^2$合成子来说,烯醇化的位置也有不同的可能,不过不同条件有利于形成不同的烯醇,我们可以通过控制反应条件来生成我们想要的烯醇。酸性条件下有利于形成多取代的热力学烯醇,而碱性条件下有利于形成取代基少的烯醇负离子,同时位阻等条件也会影响烯醇的生成。
值得注意的是,甲醛也是一个很好的无α-H亲电试剂,但是它活性太高,以至于经常会生成多取代物,为了控制甲醛的反应性,我们常使用Mannich反应来实现单次的加成。
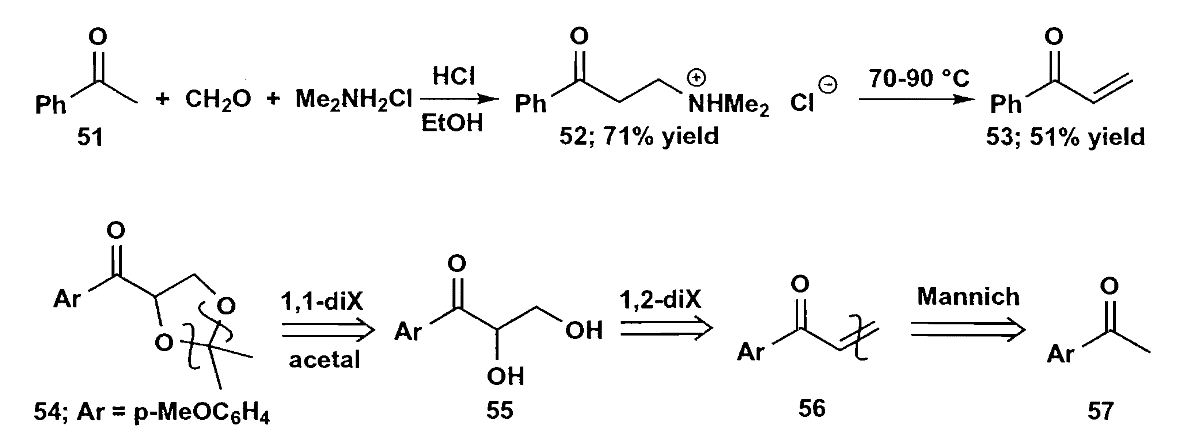
无α-H的化合物确实很好,但是不是任何时候都能用的,我们很多时候不得不考虑两种羰基化合物都能烯醇化的情况,这时候我们可以选择一些特定的烯醇化物来解决问题(1)(3),例如β-二羰基化合物和烯醇的锂盐。
β-二羰基化合物的α-H酸性比一般羰基化合物更强,因此更容易被碱攫氢生成烯醇。非常常用的两类合成试剂是丙二酸酯和乙酰乙酸乙酯类,由于β-羰基酯类很容易加热脱羧,所以多余的基团很轻松就可以脱去,这也是一个很重要的优点。
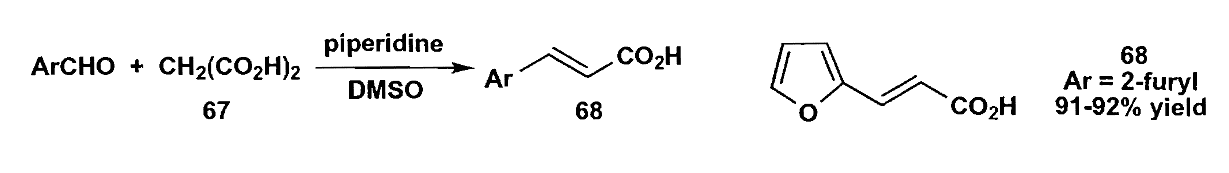
酯的烯醇锂盐可以用LDA或LiHMDS等位阻碱制备,由于碱巨大的位阻,往往得到动力学烯醇。这种方法与丙二酸酯法的一个不同在于烯醇锂盐趋向与不饱和醛酮的羰基直接加成,而丙二酸酯会发生共轭加成。而且丙二酸酯的加成产物会在反应条件下脱水,烯醇锂盐的反应会给出不脱水的aldol产物。
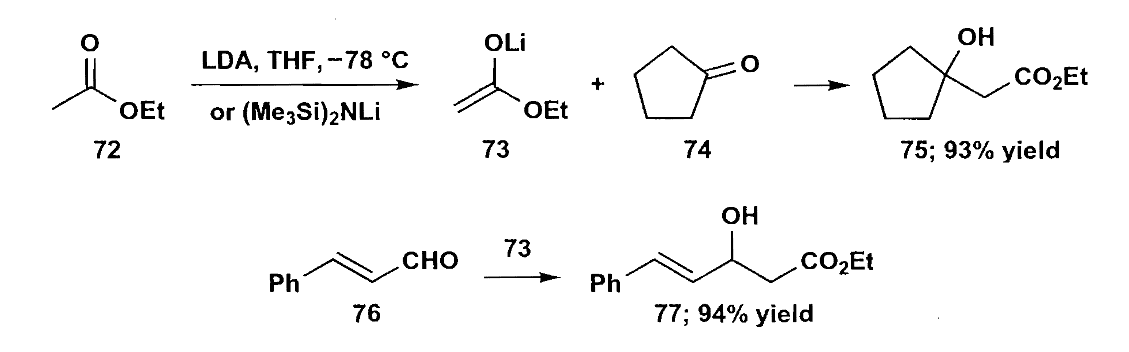
除了上述二者,我们还可以用Wittig试剂,烯胺作为特定的烯醇化物。
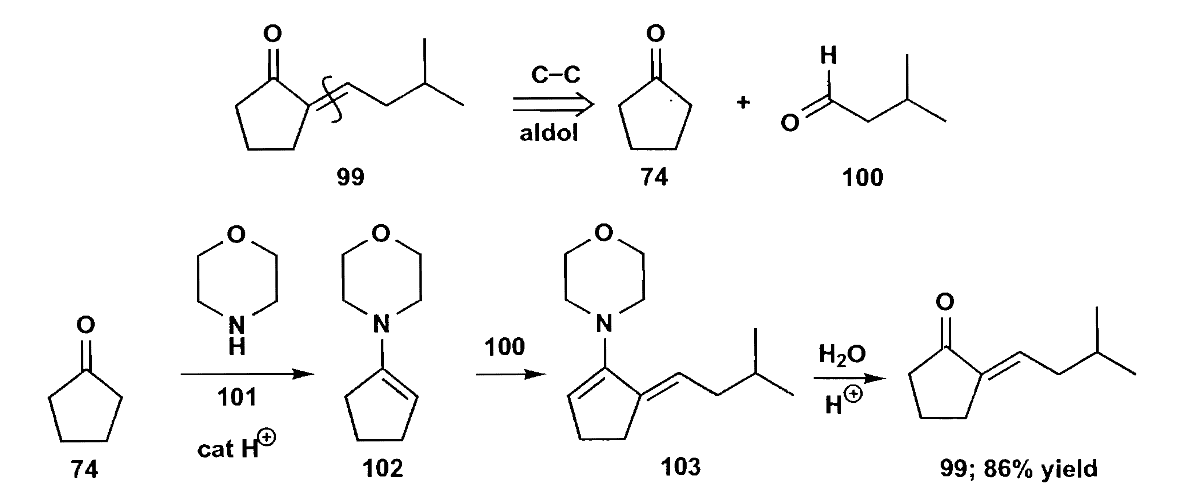
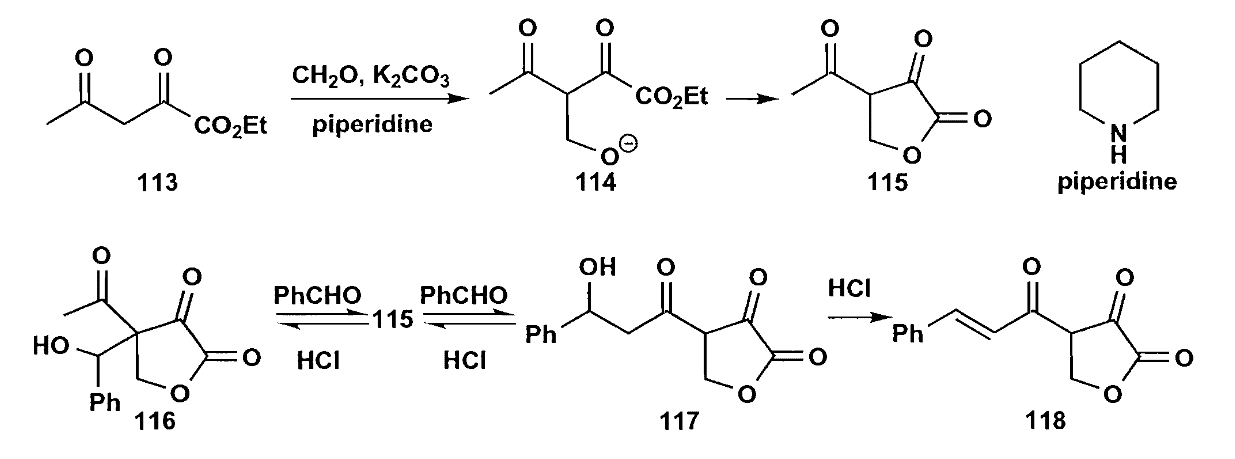
最后一点,羟醛缩合是一个可逆的反应,因此β-羟基醛酮脱水可以拉动平衡,使得缩合反应继续进行。如下图的反应,虽然二羰基化合物中间的α-H酸性更强,但是生成的β-羟基酮无法脱水,而在另一侧反应可以正常的得到不饱和酮,因此在平衡的拉动下,反应最终完全生成了不饱和酮产物(即下图中118)。
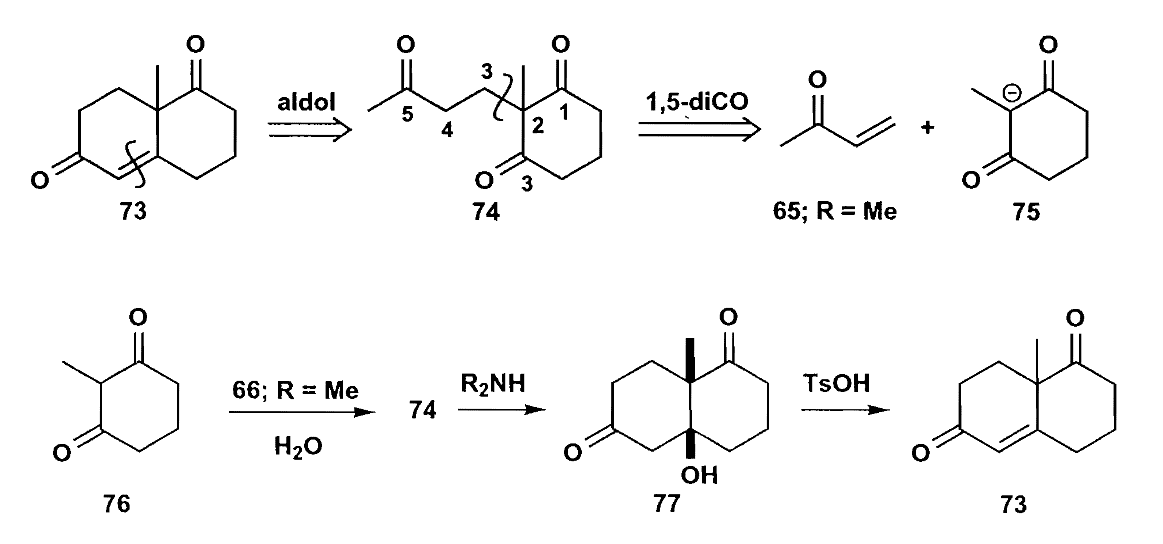
3 1,5-二官能团化合物
除了1,3-二官能团化合物之外,1,5-二官能团化合物的切断也是满足正常极性的。1,5-二酮的切断可以得到一个$\bold d^2$和一个$\bold a^3$合成子,它们的反应就是共轭加成。
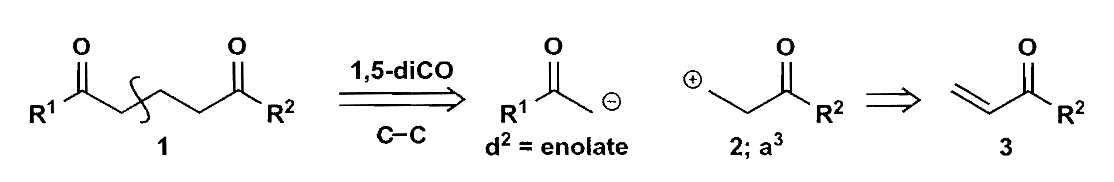
随之而来的问题是,如何控制加成的区域选择性?基础有机中已经讨论过,强亲电性的化合物容易发生直接加成,而亲电性弱的化合物容易发生共轭加成;强亲核性的烯醇化物(如锂盐)易发生直接加成,而亲核性弱的烯醇化物(如烯胺和1,3-二羰基化合物)易发生共轭加成。
因此我们在进行共轭加成时应当优先选用亲核性较弱的烯醇化物,下面介绍几个常用的试剂。
1,3-二羰基化合物是一个很好的选择,它参与的共轭加成很容易发生,往往可以得到很好的收率,比如下面这个例子:
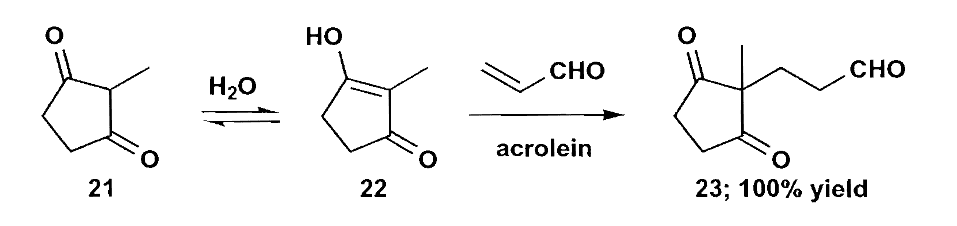
Stevence在合成coccinelline时,通过初步的切断和分析后,得出需要一个对称的酮,它可以由两个1,5-二羰基化合物反应得到。
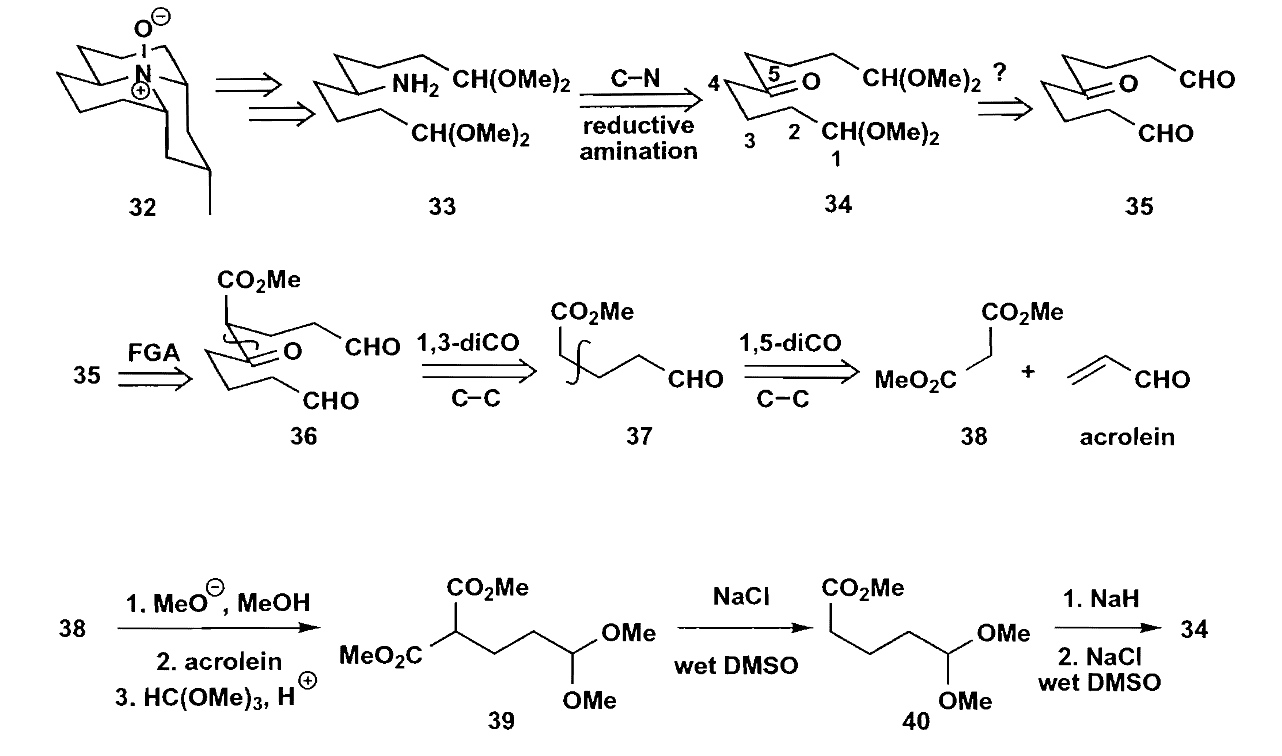
流程中在脱除酯时使用了Krapcho反应,这是在湿的DMSO中加入钠盐或钾盐直接脱除酯基的反应,免去了水解时对保护基的影响。
烯胺也是一个不错选择,反应完成后酸水解即可得到产物。
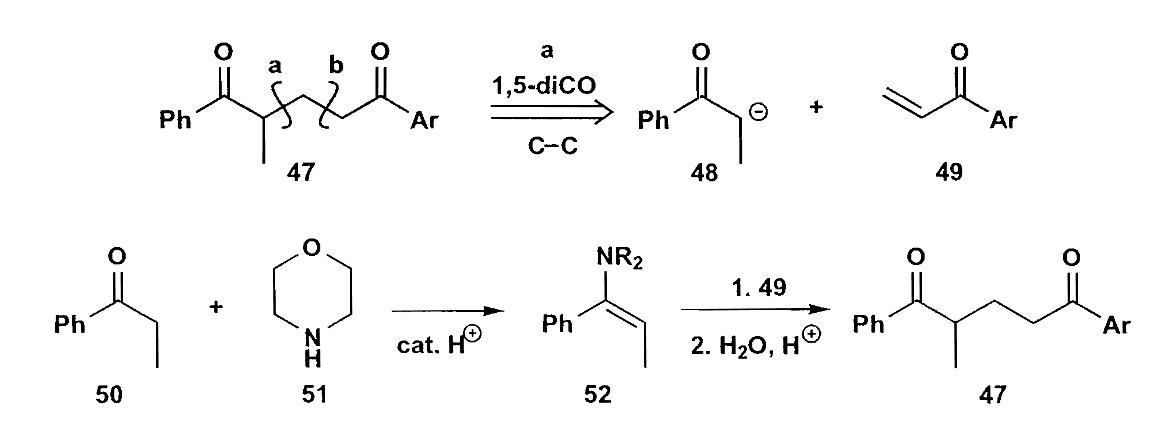
还有烯醇硅醚也是一个非常好的选择,不过本书作为一本基础读物没有详细介绍,更进一步的内容可以参考《策略与控制》。
说完了亲核试剂,亲电试剂的选择也值得一谈。在共轭加成中,一个好的受体应该满足下面的要求:
- 不会受到直接进攻的化合物,如硝基烯或腈基烯等。
- 羰基亲电性弱的化合物,如不饱和酯,不饱和酰胺等。
- 烯烃的亲电末端无取代的化合物,这些化合物在发生共轭加成时位阻小,反应活性高。
- 羰基α为有活化基团的化合物,如α位有酯基、卤素、硅基取代的α,β-不饱和酮等,同时这些活化基团应当容易去除以便后续转化。
上述的要求不是强制性的,实际上,在亲核试剂选择得当的条件下,绝大多数的α,β-不饱和酮都可以发生共轭加成反应。
看两个共轭加成的例子。第一个是Robinson增环。
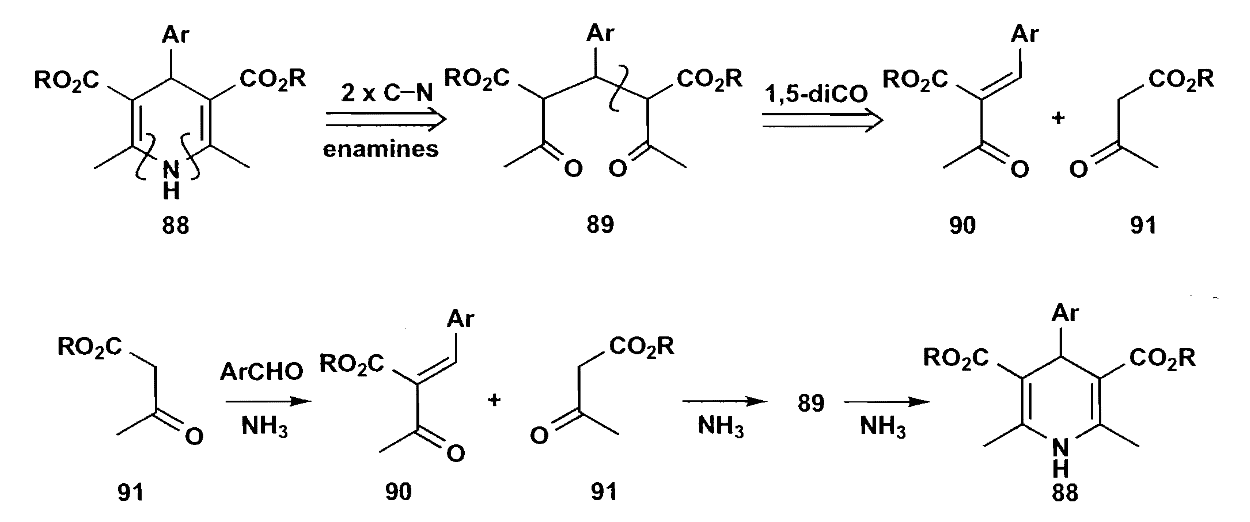
第二个是吡啶的制备,类似于Hantzsch吡啶合成。
4 1,2-二官能团化合物
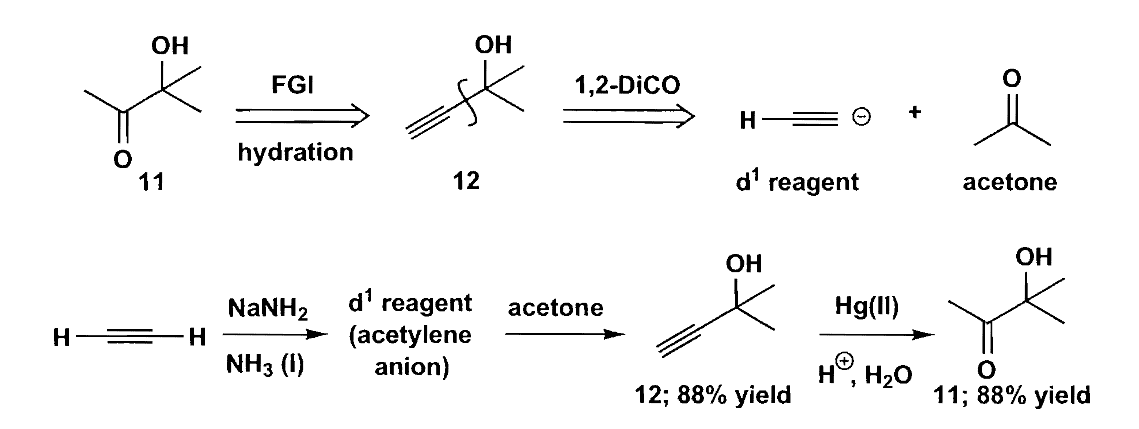
对于1,2-二羰基化合物,通过分析发现,它的极性是反常的,无法直接通过羟醛缩合反应连接,因此我们不得不另辟蹊径。切断羰基中间的C-C键得到一个$\bold d^1$合成子和一个$\bold a^1$合成子,因此找到极性反常的$\bold d^1$合成子就是我们面临的主要问题。
最简单的$\bold d^1$合成子是氰基负离子,氰基与醛酮加成后,通过各种转化可以变为醛、羧酸、胺等等基团。不过氰基的问题在于只能增加一个碳,一个更加通用的选择是末端炔烃,炔钠和醛/酮加成后水解就得到α-羟基醛/酮。
另外一个值得重点介绍的$\bold d^1$合成子是硝基烷烃,硝基烷烃的α-H酸性很强,可以被碱夺去形成类烯醇化物,同时硝基本身又不会被亲核进攻,所以它是一个很好的亲核试剂。硝基化合物可以被还原为酮或氨基,从而可以发生后续转化。
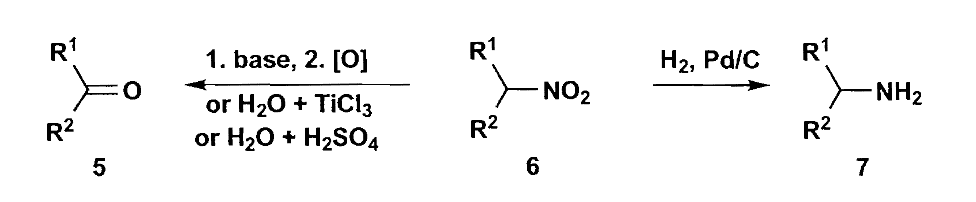
硝基可以转化为“烯醇”形式后在酸条件下水解为胺,称为Nef反应,但是该反应太过剧烈,因此不是一个好的选择。硝基还可以使用臭氧/高锰酸钾氧化其中的C=N双键生成酮,再或者可以用$TiCl_3$发生类似McMurry反应生成酮。
看一个硝基化合物在合成中应用的例子。
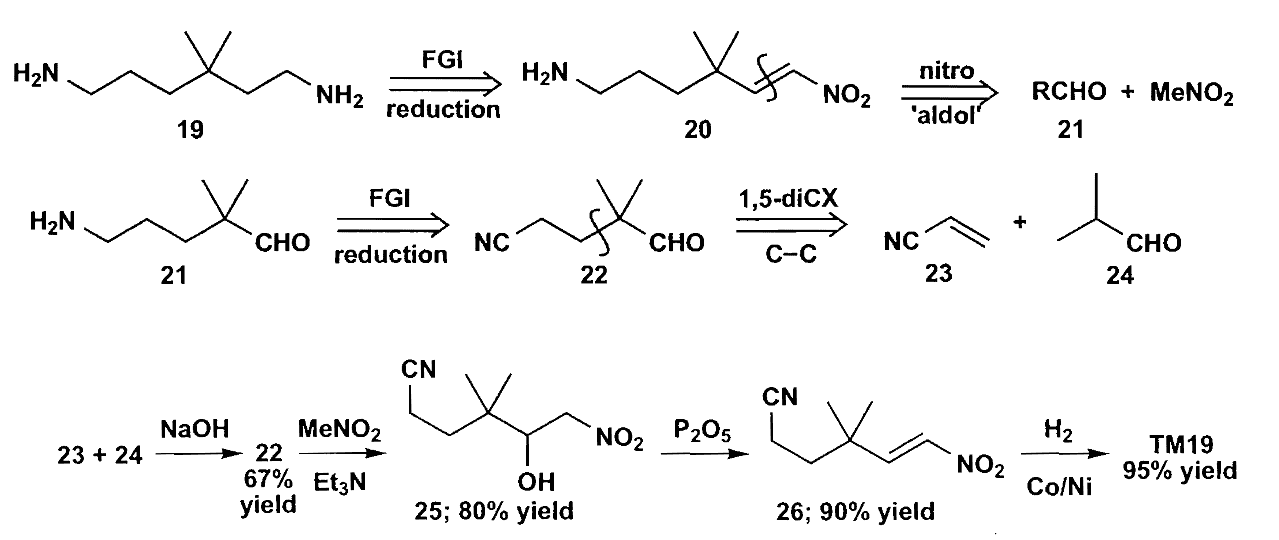
书中总结了硝基化合物能够代替的合成子,都是反转极性的$\bold d^1$或$\bold a^2$合成子,对于1,2-或1,4-二官能团关系的化合物的合成很有帮助。
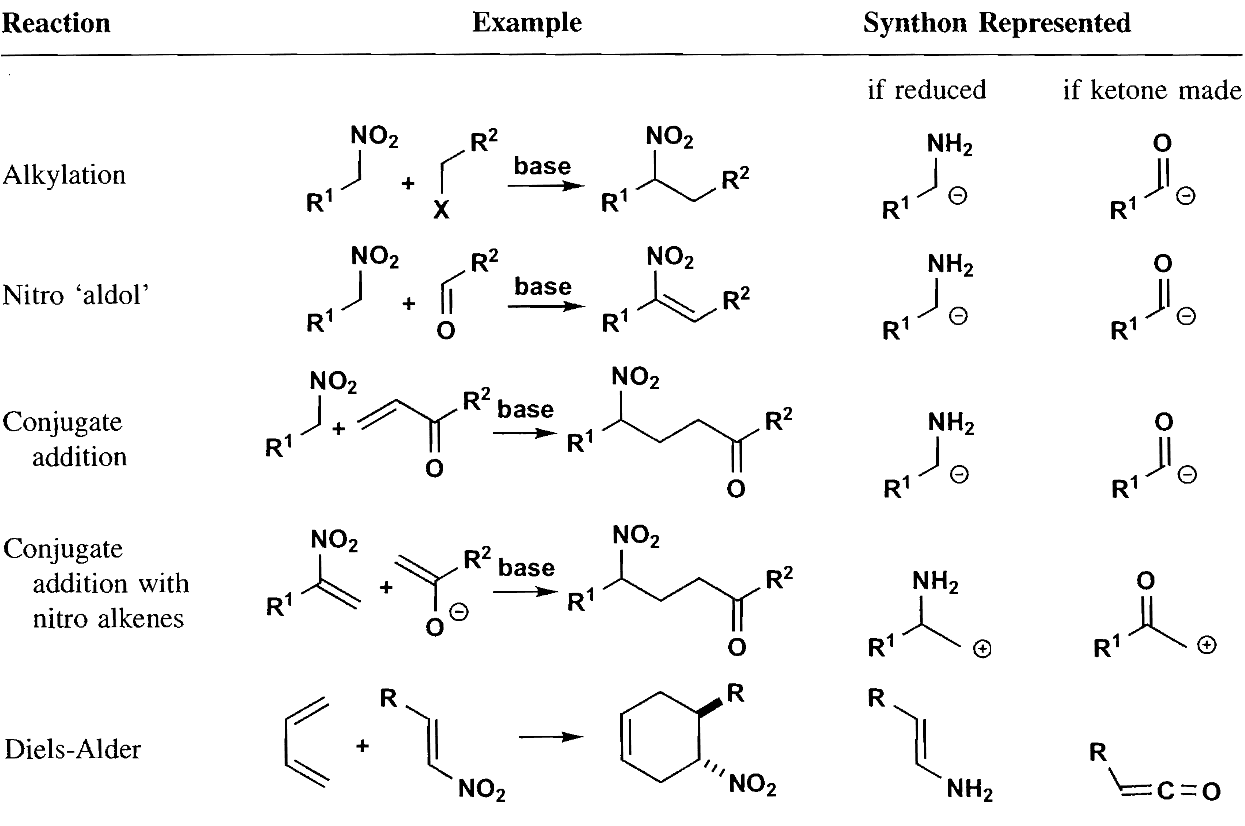
除了使用这些特殊的合成子之外,我们也可以把羰基碳的极性翻转,使其成为$\bold d^1$合成子,称为极性反转(Umpolung)反应。例如将醛酮制备为缩硫醛酮,然后使用强碱去质子化,可以把羰基碳从正电性改变为负电性,作为亲核试剂去进攻其他羰基化合物,该反应也称Corey-Seebach反应。
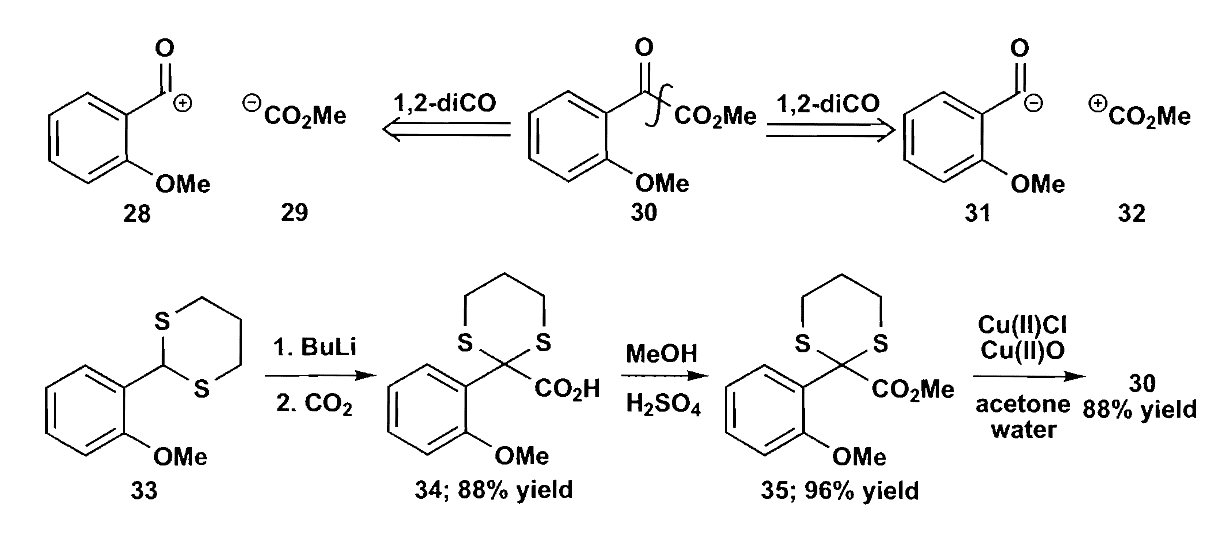
二噻烷很容易合成,稳定且易于使用,但是去保护很困难,所以限制了它的应用。
类似的反应还有安息香缩合,无α-H的芳醛在氰基催化下可以缩合为α-羟基酮。该反应现在已使用氮杂环卡宾(NHC)来替代有毒的氰基。
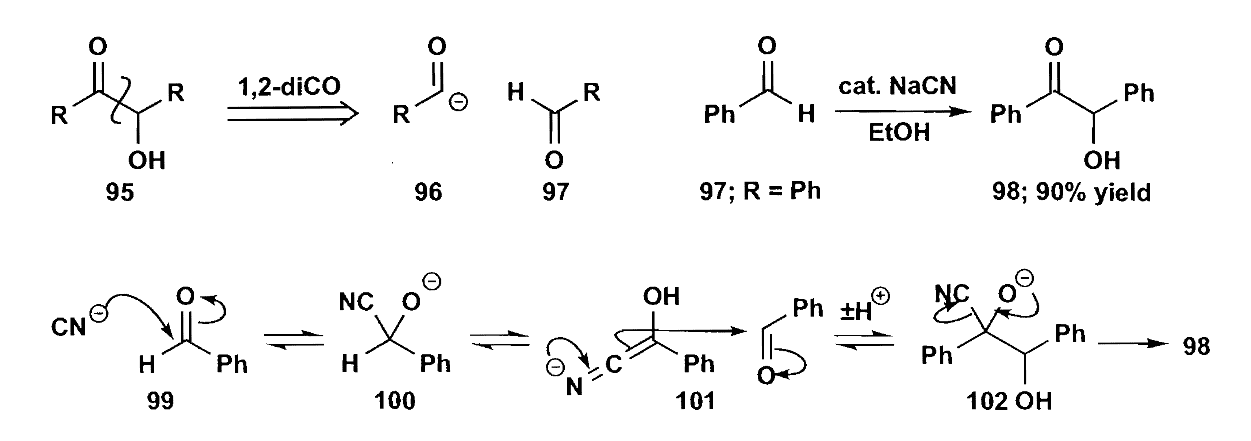
1,2-二官能团的合成还有一个思路,也就是通过烯烃来转化,例如双羟化和环氧化再开环都是常见的方法。
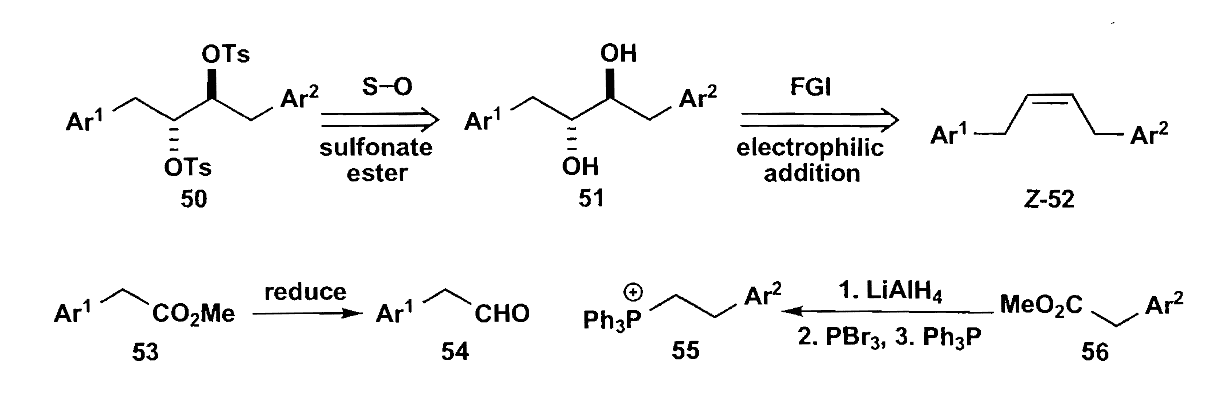
羰基化合物α-官能团化也是一个选择,例如使用氧化剂直接氧化酮的α位,或是烯醇在酸性条件下亚硝化。
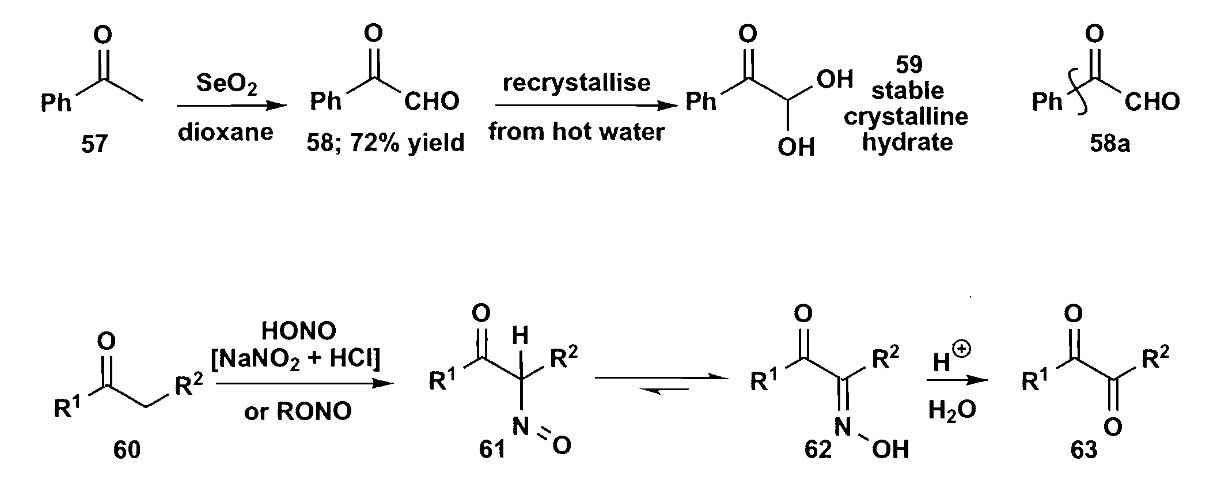
最后是利用自由基反应构建1,2-二官能团结构,如pinacol反应(注意不是pinacol重排),酮在钠或镁作用下生成二聚体。
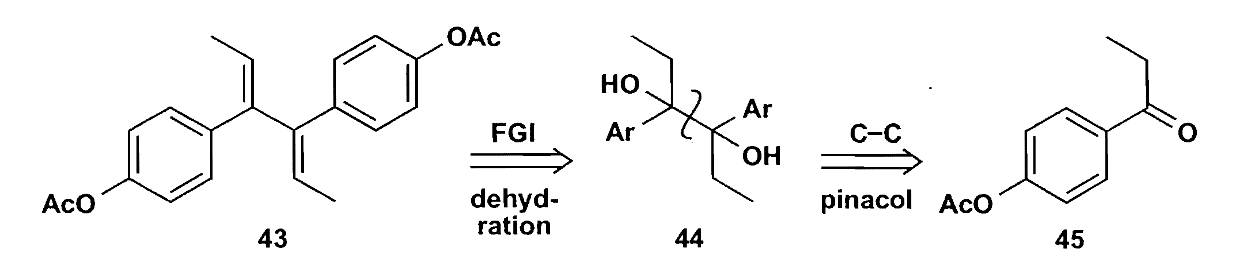
类似的反应还有酮醇缩合,二酯在钠的作用下缩合为1,2-二酮,但是反应不会停在这一步,随即继续还原生成α-羟基酮。
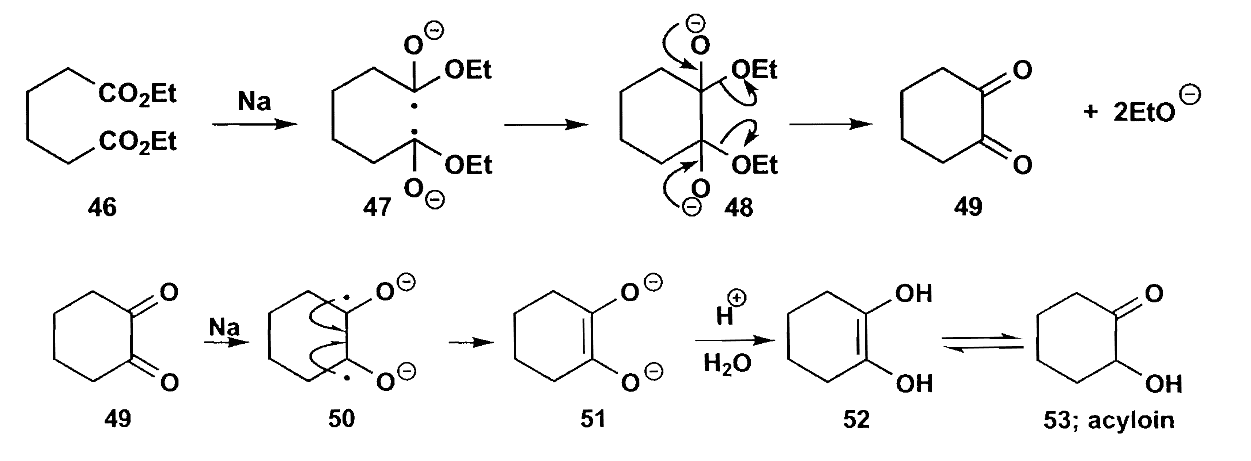
如果在反应体系中加入$TMSiCl$,那么生成的烯二醇(即上图中51)可以被捕获形成烯醇硅醚中间体。这一方法还有一个好处是$TMSiCl$还能捕获从酯上脱下来的烷氧基,因此就不会被烷氧基催化而发生酯缩合。这可以防止易烯醇化的酯发生酯缩合,减少副反应的发生。
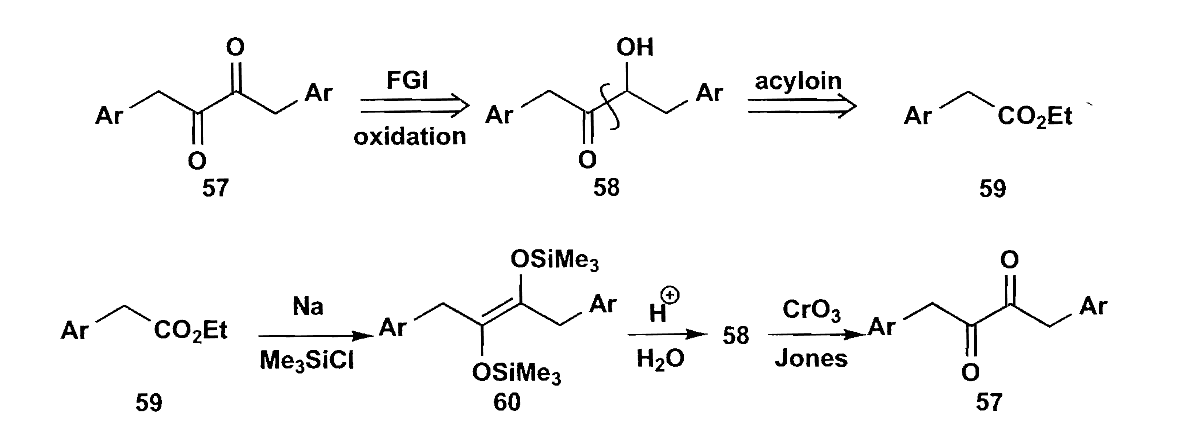
5 1,4-二官能团化合物
1,4-二官能团化合物可以按照1,2-二官能团化合物的合成照猫画虎,使用$\bold d^1$合成子和$\bold a^3$合成子来共轭加成,另一种思路是$\bold d^2 + \bold a^2$,$\bold a^2$虽然是反常极性的,但是α-卤代酮/酯作为$\bold a^2$合成子都是容易制备的。
来看一个$\bold d^2 + \bold a^2$的例子,抗生素甲基霉素(methylenomycin)的合成。
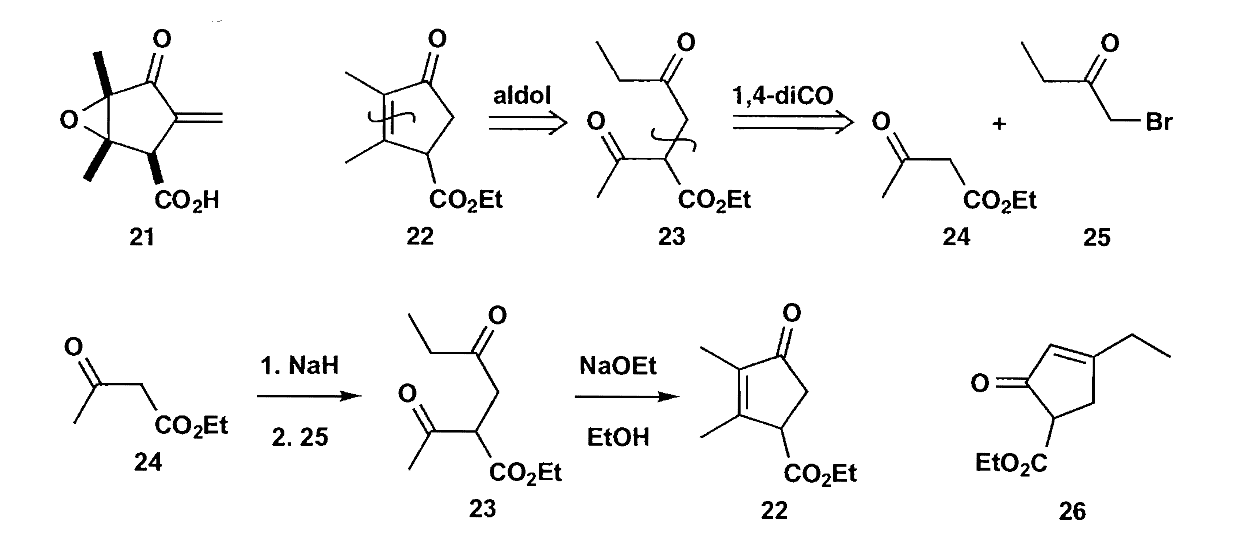
环氧化合物也是一个好用的$\bold a^2$合成子。
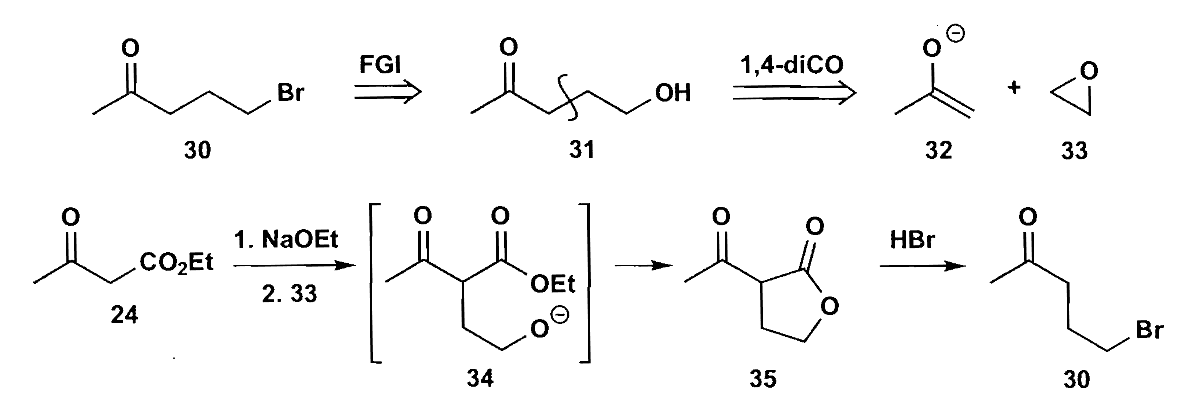
但是需要注意可能的副反应,如下图反应中,当3与4反应时,结果不会得到5,因为烯醇锂盐会倾向于发生对羰基的直接加成。如果我们把α-溴代酮变成烯丙基溴,那么就杜绝了副反应的发生,最后只需要把双键氧化即可,这种方法我们不妨称作重接(reconnection),即补充一个碳把官能团完成转化。这种方法可以在许多地方发挥作用,你也可以把它当作是官能团转化(FGA)。
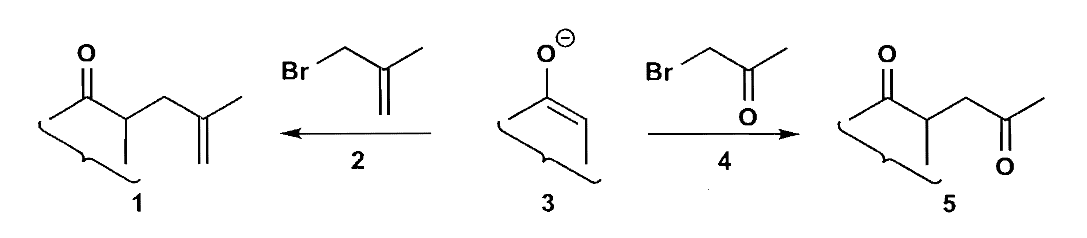
至于$\bold d^1 + \bold a^3$,和1,2-二官能团的合成是类似的,只不过由直接加成改为共轭加成,此处只展示几个例子。
氰基作为$\bold d^1$合成子发生共轭加成,实际操作中,氰基与肉桂酸的加成很慢,所以需要引入第二个吸电子基。
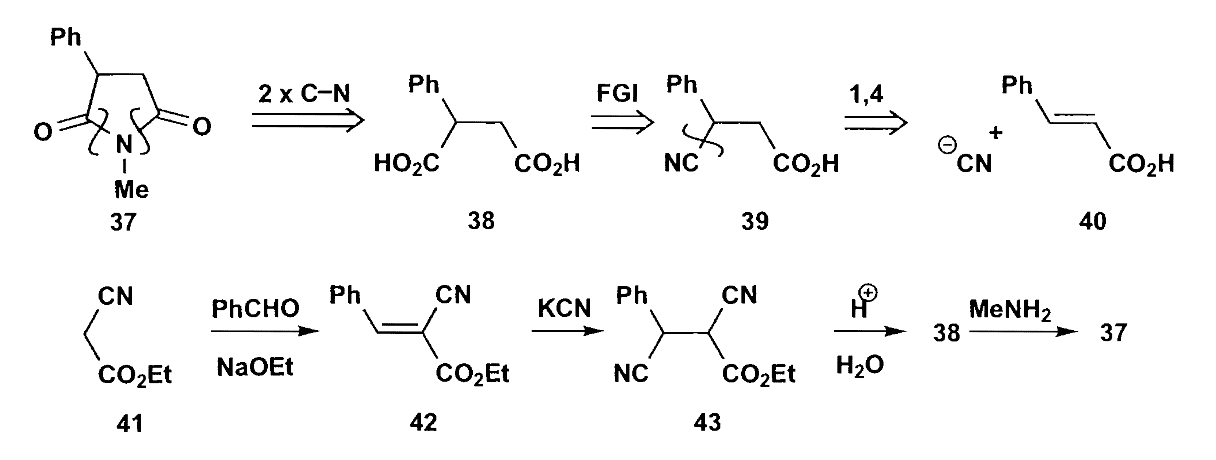
硝基烷基作为$\bold d^1$合成子发生共轭加成,然后将硝基氧化为羰基。
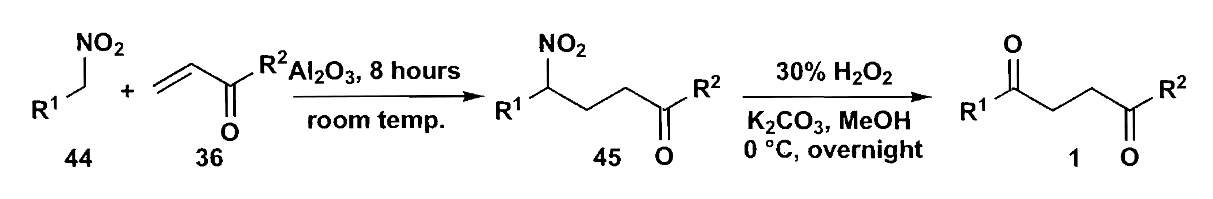
当然我们还有另一种思路,那就是使用$\bold d^3 + \bold a^1$,$\bold a^1$是很常见的合成子,但是$\bold d^3$就不那么常见,这种高烯醇化合物通常不太稳定,但是也有例外,即形成三元环硅醚。
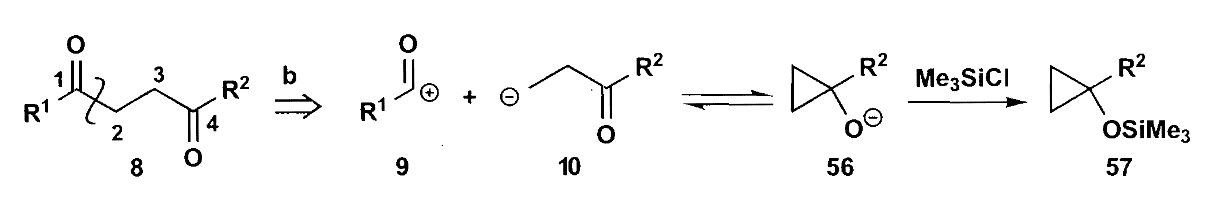
这种硅醚衍生物通常使用β-卤代酮和锌反应得到,锌在插入C-X键时已经完成了极性的反转。
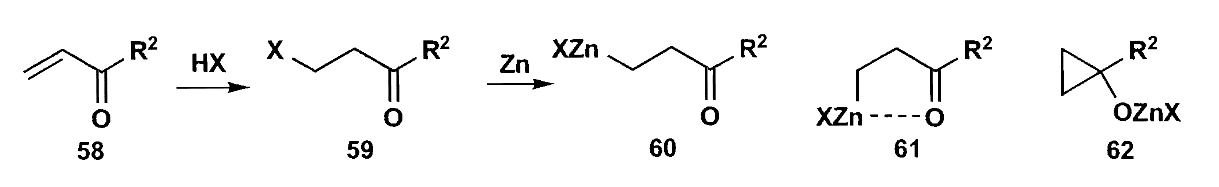
更多高烯醇化合物的内容参见《策略与控制》,此处按下不表。
最后,我们还可以在乙炔两端添加官能团来实现1,4-位置关系。
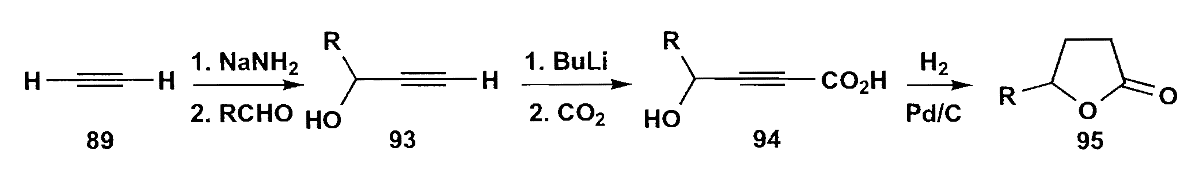
6 1,6-二官能团化合物
对于1,6-二官能团化合物来说,虽然可以切断为$\bold d^3 + \bold a^3$或者别的方式,但是这两个官能团实在隔得有点远,很难发生我们所需的反应,因此我们需要另辟蹊径。
一个好的策略是把环己烯氧化,双键切断后恰好是1,6-二官能团关系。同时环己烯结构也是易于制备的,不管是环己酮脱水或者借助Diels-Alder反应都可以生成六元环烯。
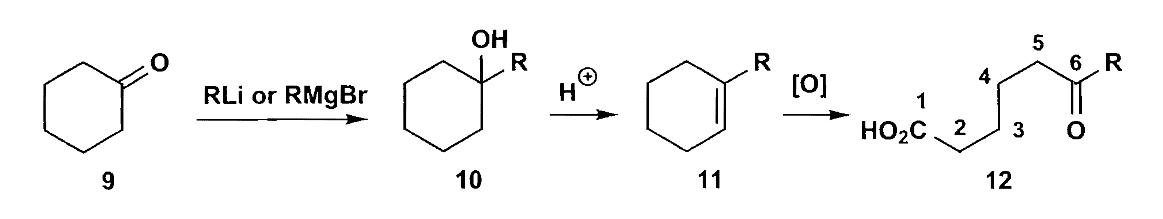
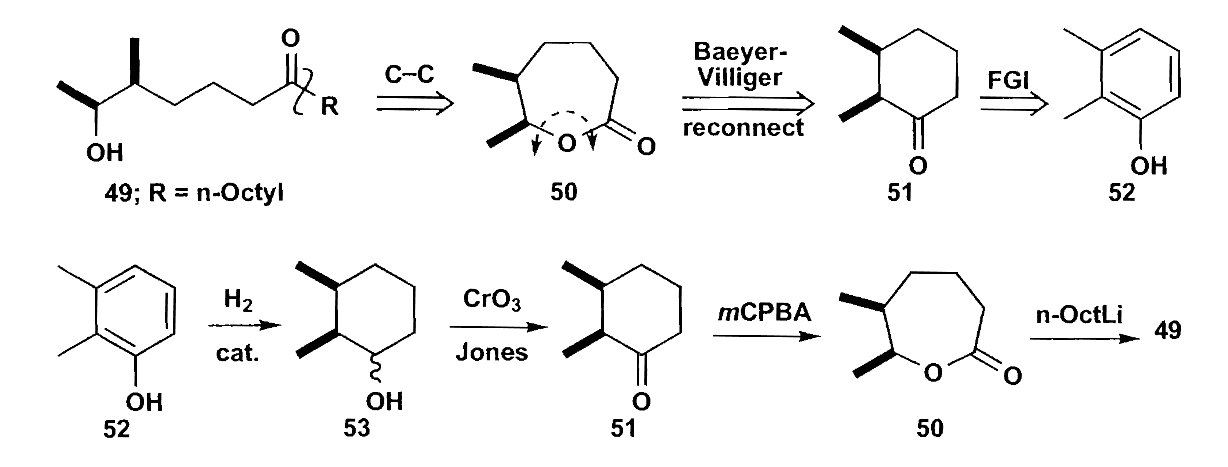
除了氧化断裂,我们还有氧化重排,六元环酮被过氧酸氧化后得到七元环内酯,称为Baeyer-Villiger氧化重排。重排后自然具有1,6-二官能团关系。
7 羰基切断综合示例
在讨论了各种关系的切断后,最后来看几个综合例子吧。
第一个例子是一个具有很高对称性的缩酮,在做切断时,应该尽量保留它的对称性。在这里,一个可行的方法是额外添加一个酯基再切断,这样对称性就可以很好的保留。
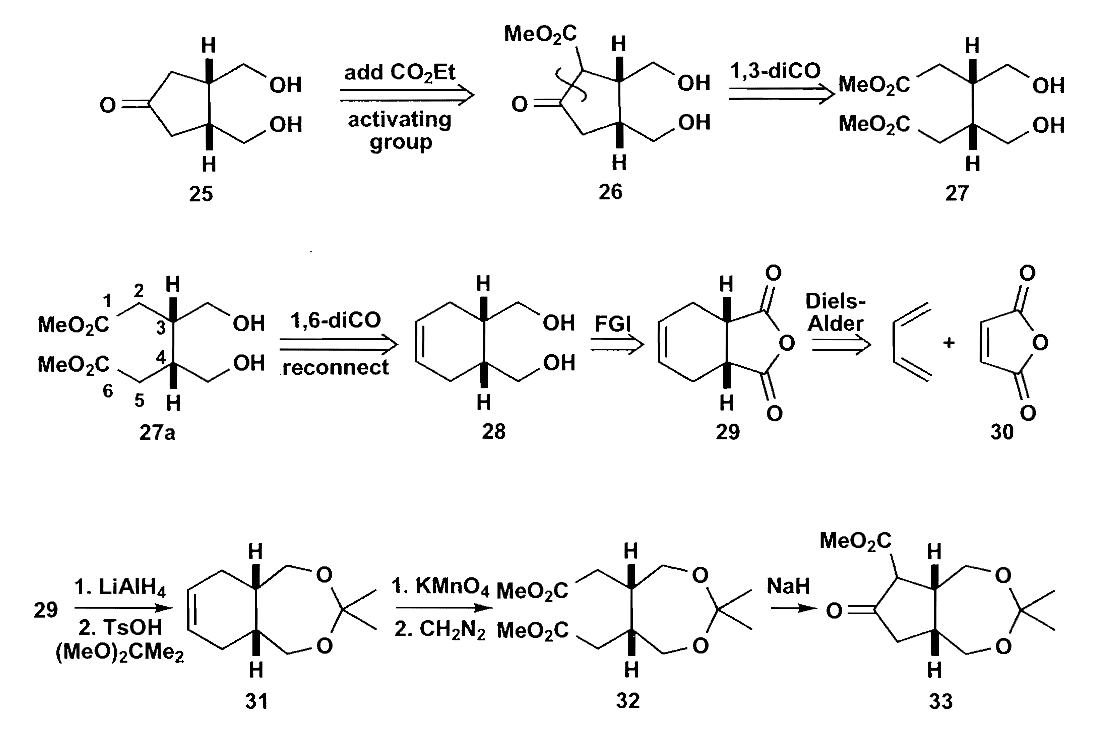
接着利用D-A反应构建六元环即可。
第二个例子是一个杂环二酮的合成,该物质可以用来合成抗精神失常药物匹喹酮。
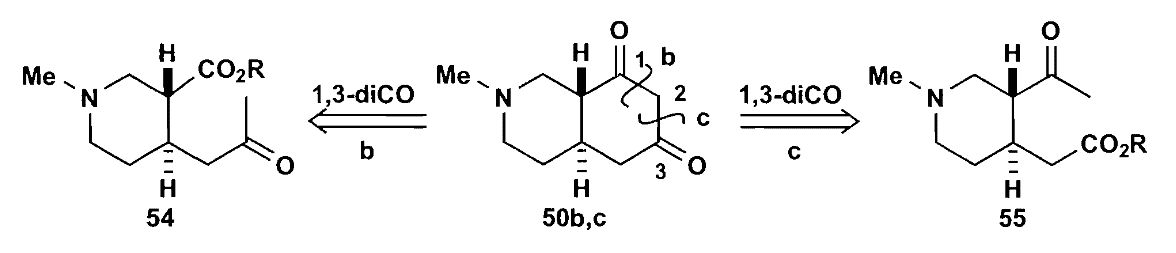
如果首先切断环中的N原子两侧的键,那么会得到一个四羰基的化合物,其选择性很难控制,不是一个好选择。因此可以先切断1,3-二羰基中间的键,不过暂时还看不出两种切断的优劣,不妨继续尝试。
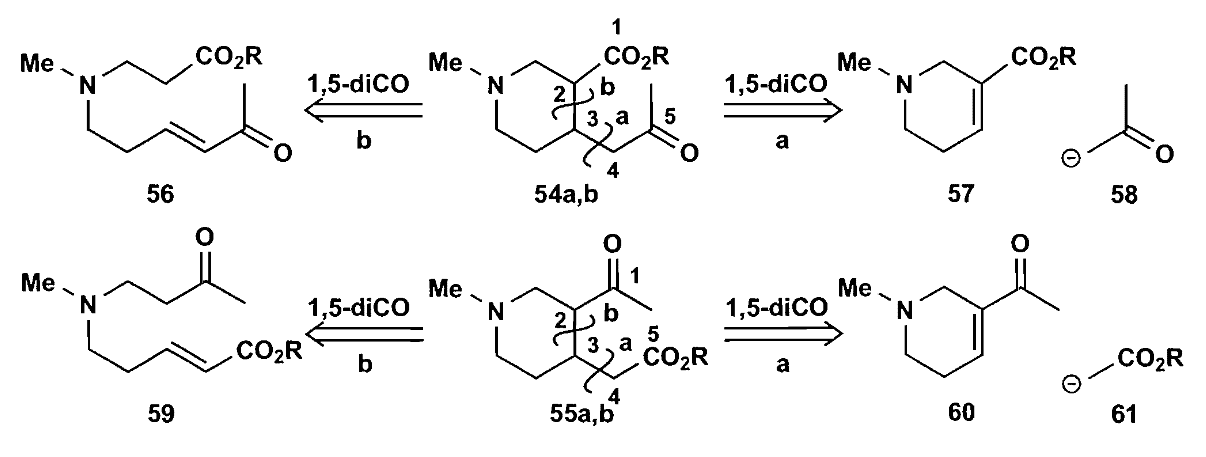
继续切断后发现,上图中切断a得到一个长链,对问题简化没有帮助;而切断b得到两个小分子,看起来更加可行,因此选择切断b,尝试上图中57+58或者60+61的方法。
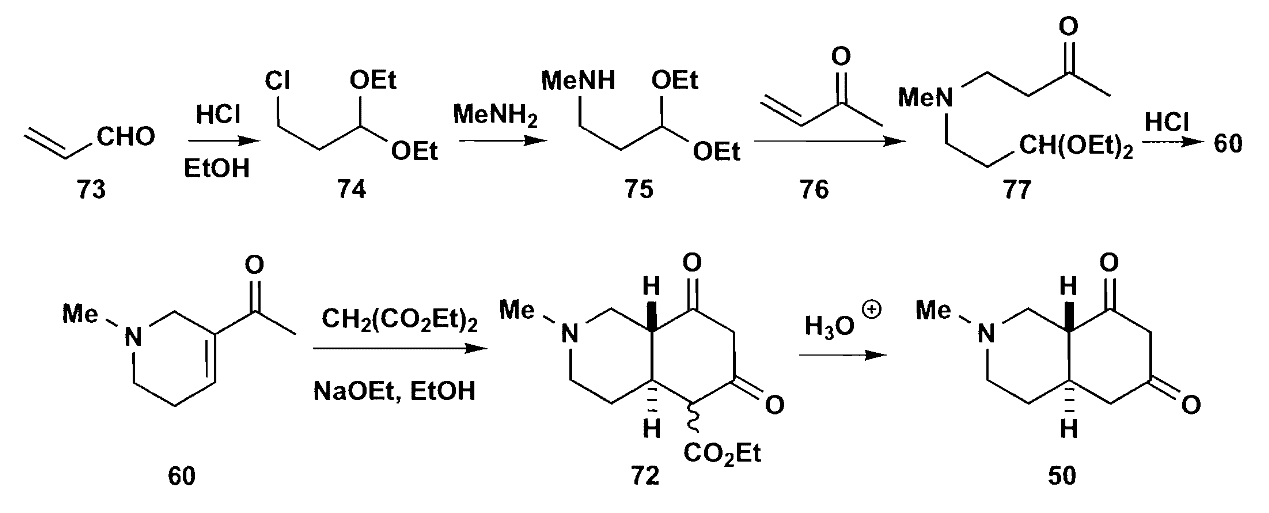
实际上化合物57是天然产物槟榔碱,可以直接拿过来用,但是实际操作中发现57会在强碱条件下发生开环-关环的重排,所以我们最终选择了60+61。
总结
不难看出,羰基化合物的合成无疑是有机合成中非常重要的一部分,这里介绍的合成思路对于复杂化合物的合成也是很有帮助的。