《中级有机化学》章末总结8
第八章介绍消除反应,这章新东西比较少。
第8章 消除反应
消除反应根据两个基团的相对位置分类可以分为α-消除、β-消除、γ-消除等,β-消除是最为常见的反应类型之一,本章着重介绍α-消除和β-消除。
8.1 α-消除
α-消除即两个基团在同一个碳上,发生消除后会生成卡宾等活泼中间体。
卤代烃在碱性条件下失去同碳上的卤化氢得到卡宾,经典的例子是氯仿的α-消除:
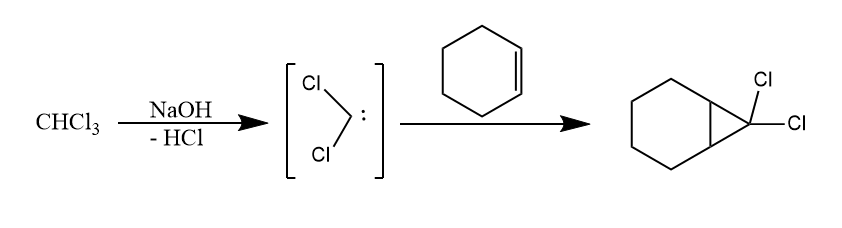
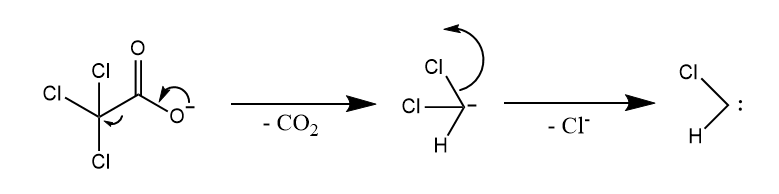
三氯乙酸盐在加热条件下发生热解也发生α-消除。
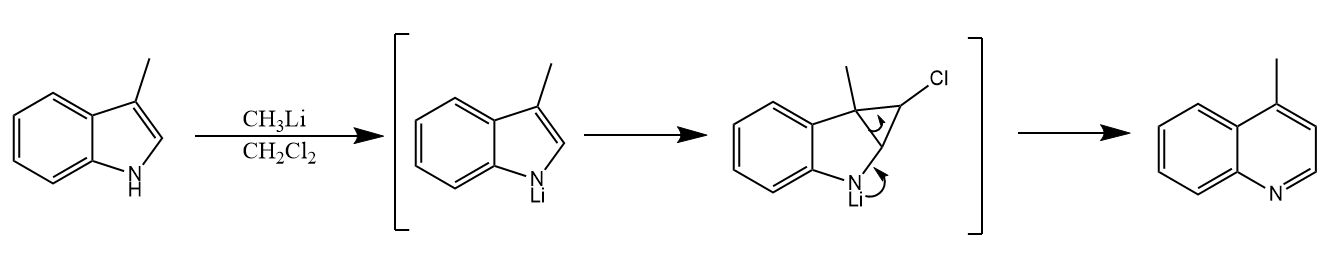
二氯甲烷在强碱作用下发生α-消除得一氯卡宾,这种方式产生的一氯卡宾比二氯卡宾更活泼,可以与苯、吲哚或吡咯的双键发生环丙烷化反应并得到扩环产物。
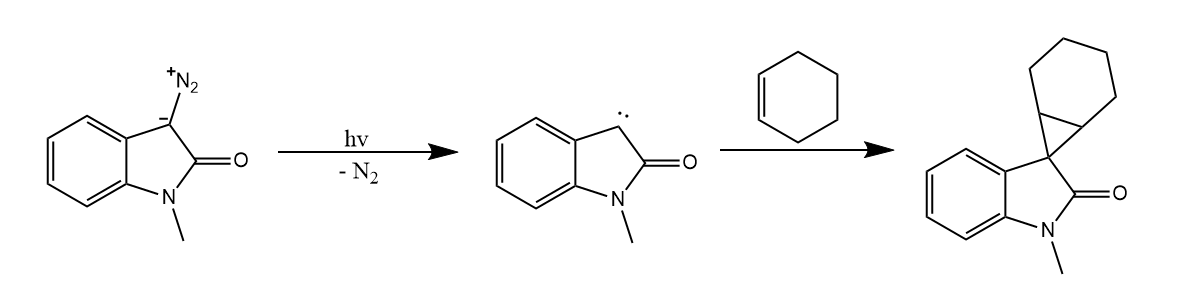
烯酮、重氮化合物、叠氮化合物的光解或热解,能产生卡宾或乃春,此法在合成中已被广泛应用:
酰基叠氮化合物在光解或热解时,产生酰基乃春,后者发生1,2-重排转化为异氰酸酯。
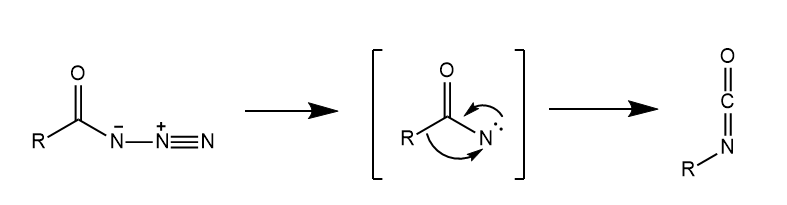
异氰酸酯是许多重排反应的中间体,比如Hofmann重排、Lossen重排、Curtis重排等等,这些反应都大同小异。
卡宾非常活泼,除了环丙烷化反应外,还会发生C-H键插入等反应,因此环丙烷化往往用其他方法来提高选择性,例如Simmons-Smith反应,该反应使用Zn-Cu合金和二碘甲烷原位生成的有机锌试剂()将烯烃专一化地转化为环丙烷衍生物。
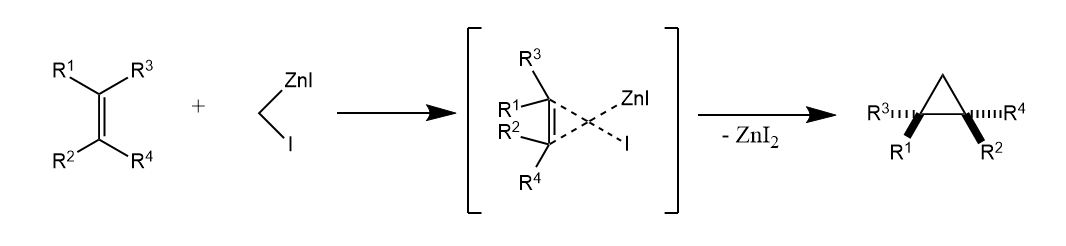
Simmons-Smith反应的一个常用试剂为Furukawa试剂,即和原位生成的,其优点是反应活性高,操作简便:
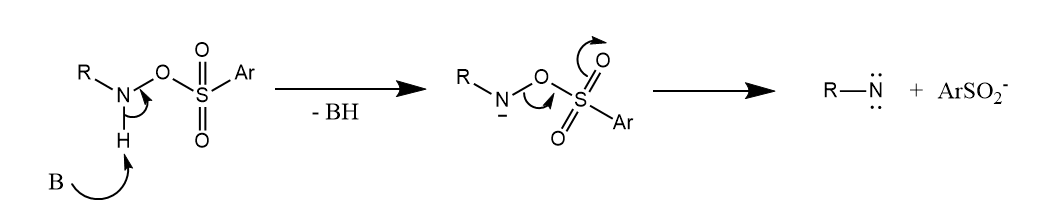
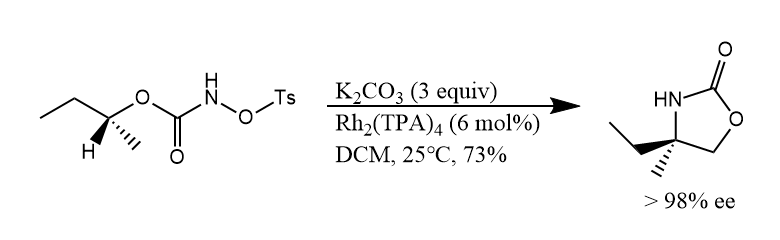
N-烃基羟胺的磺酸酯在碱作用下可发生α-消除形成乃春。
过渡金属能和乃春形成较稳定的金属乃春(),这一点极大地拓展了乃春在有机合成中的应用。例如在催化量的铑配合物存在下,反应物经铑乃春的中间体生成分子内C-H插入的环化产物。
8.2 β-消除
β-消除可以分为和四种类型,下面依次介绍。
是单分子反应,反应速率只与卤代烃的浓度有关,与碱的浓度无关。反应经历和相同的碳正离子中间体,然后再消除氢得到烯烃。
反应具有良好的区域选择性,一般生成含有取代基较多的烯烃,即Zaitsev烯烃。因为多取代烯烃的过渡态更加稳定,能垒更低。
反应是双分子反应,反应速率与底物浓度和碱的浓度都相关,反应是协同机理,离去基团和氢同时离去。反应根据底物结构,反应试剂,溶剂,反应条件等等不同,会生成Zaitsev烯烃或Hofmann烯烃。
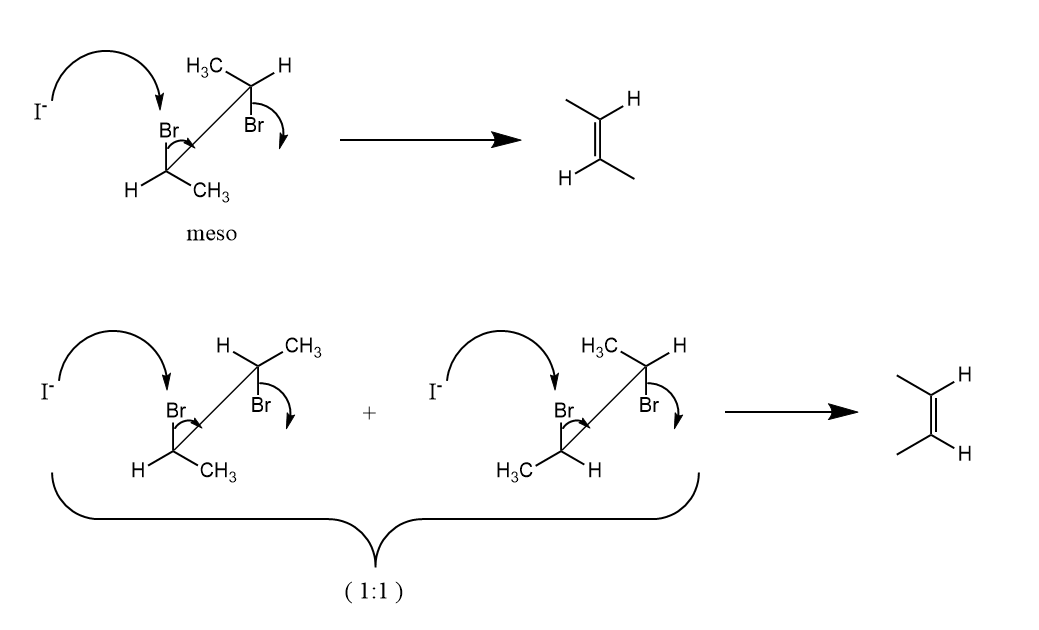
在反应中,底物中的离去基团和消除的质子处于反式共平面的构象,存在和的超共轭作用。由于反式共平面的立体化学要求,因此反应具有立体专一性,例如:
对于桥环化合物,消除所产生的双键一般不在桥头碳上,这一规律称为Bredt规则。Bredt规则背后的原理是环刚性影响了分子构型的转换,不能发生轨道的重叠。当环足够大时,由于环刚性减弱,这一规则不再生效。
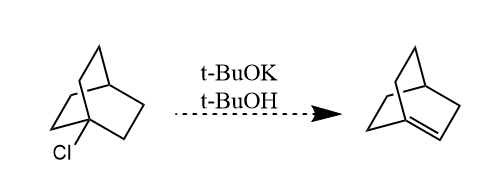
对于某型无法满足反式共平面的特殊情况下,顺式共平面的消除也是可能的。
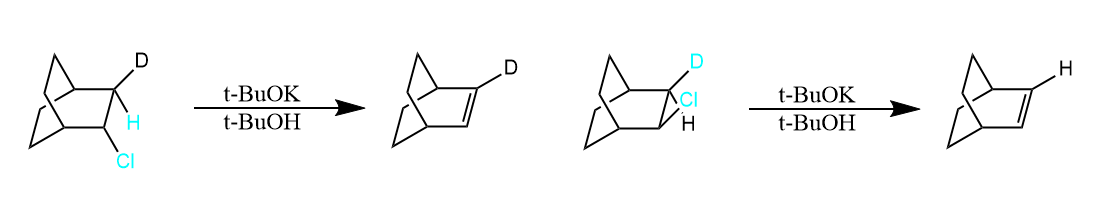
因为在刚性环中,顺式共平面也有轨道部分重叠的可能,所以可以作为一种特殊情况存在。
( 这个轨道重叠图太难画了,不画了:ρ )
季胺盐在碱性条件下的消除称为广义Hofmann消除。狭义的Hofmann消除指的是胺与过量碘甲烷反应生成季胺盐,后者与作用生成季胺碱,季胺碱热解时发生消除。
与Zaitsev消除不同,Hofmann消除中的碱优先夺取烷基较少的上的质子,生成含取代基少的烯烃,即Hofmann烯烃。因为Hofmann消除的区域选择性与Zaitsev消除的区域选择性相反。
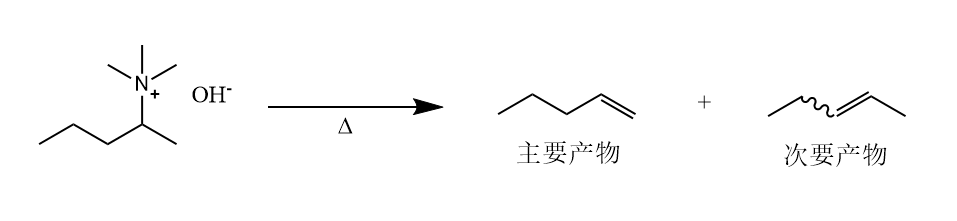
Hofmann消除的过渡态在动力学上有利,因此Hofmann烯烃是动力学产物。
Hofmann规则也存在例外,当生成的双键能被其他基团稳定时,消除的方向不再符合Hofmann规则。
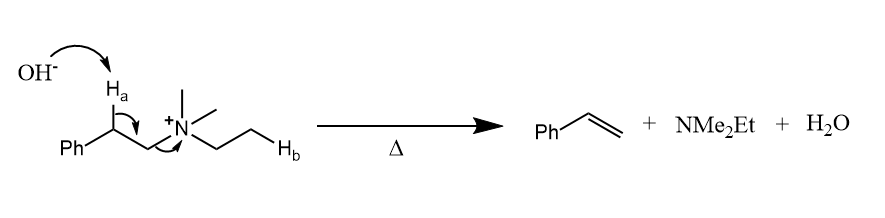
在碱作用下,先离去,生成碳负离子中间体(也就是底物的共轭碱),然后离去基团离去,这种消除称为反应。与的不同在于反应中存在负离子中间体,而反应是协同完成的。
通过机理进行的反应一般需要具有足够强的酸性(同时意味着LG能较好地稳定碳负离子)。
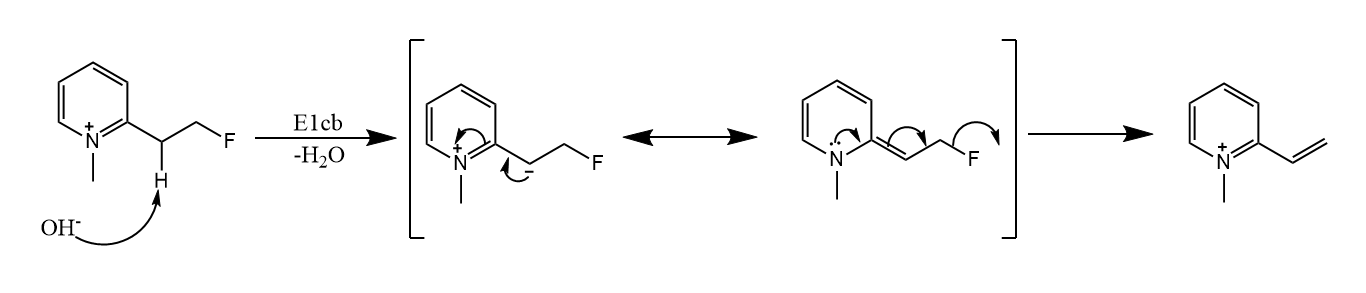
下面是另外一个例子,在下面的反应中,作为离去基团,消除产生的烯烃由于空间位阻的存在,具有较高的势能,通过两步质子转移生成热力学稳定的烯烃。
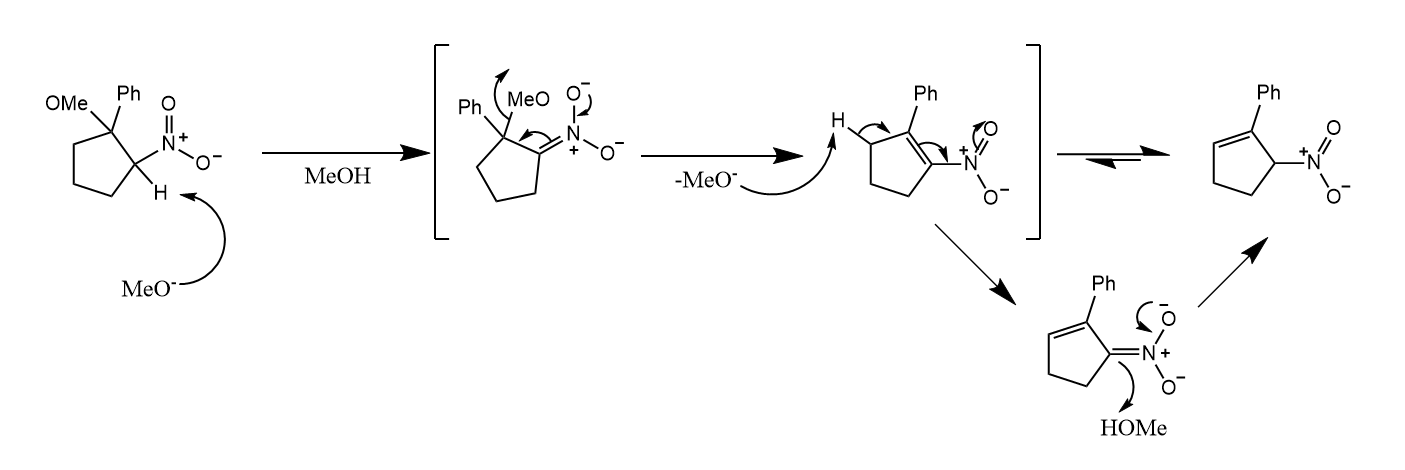
消除常见于-羟基羰基化合物脱水生成-不饱和羰基化合物的反应中,碳负离子可以因羰基共轭而稳定。
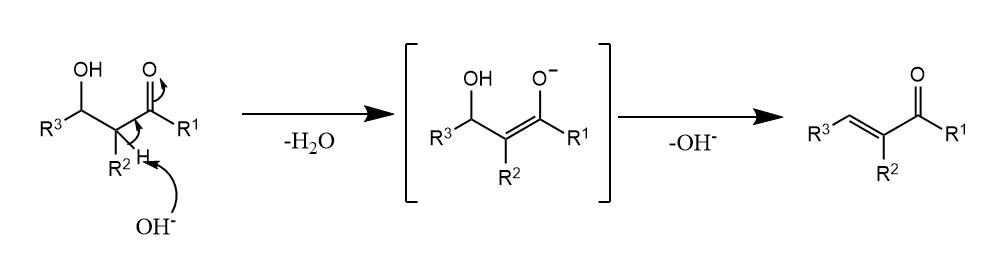
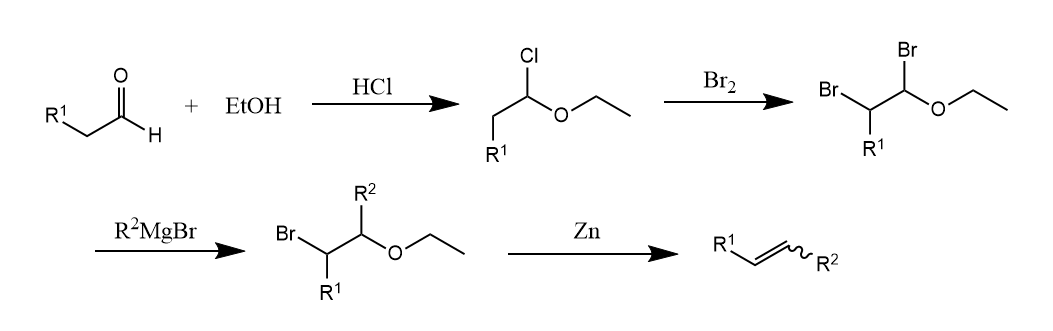
反应的另一个重要实例是Boord烯烃合成法,该反应的最后一步实际上是消除。
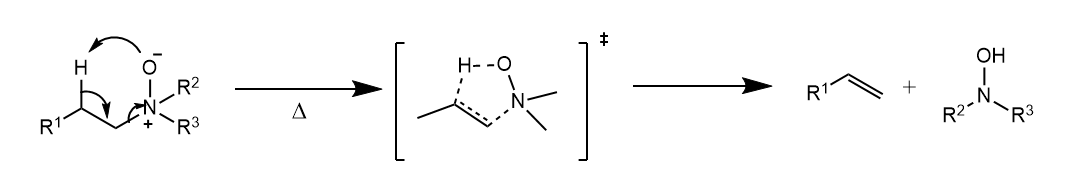
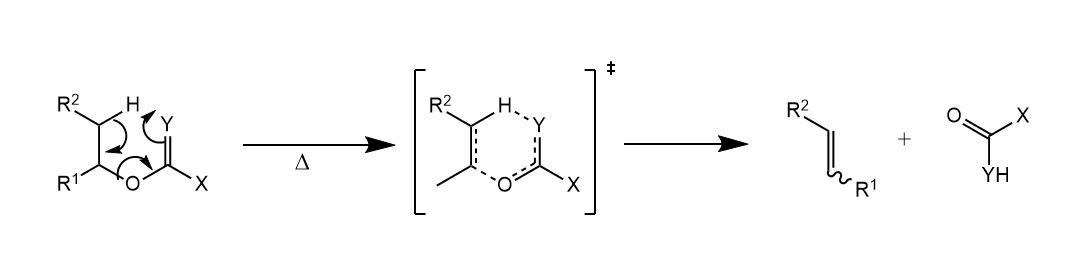
分子内消除用表示,常见于一些热解反应中,反应经过五、六元环状过渡态,立体化学特征为顺式消除。氮氧化物、亚砜和硒氧化物的热消除,以及酯的裂解等都属于消除。
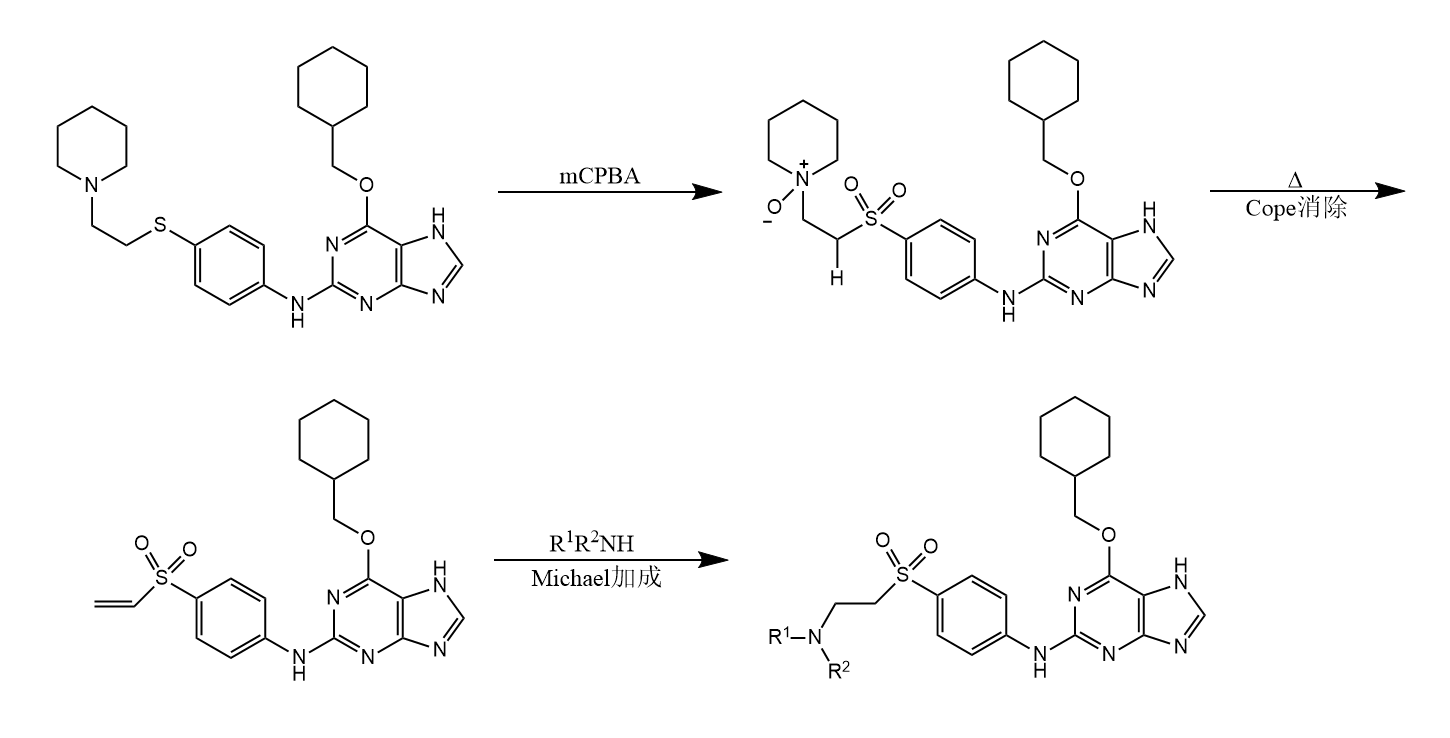
三级胺的氮氧化物消除分子内顺式消除,该反应称为Cope消除。
用mCPBA氧化三级胺,可得到氮氧化物,后者进行Cope消除,该法已经被用于有机合成。例如一种蛋白依赖激酶抑制活性化合物CDK2的合成:
Cope消除是可逆反应,Cope消除的逆反应可看作是烯烃的羟胺化。
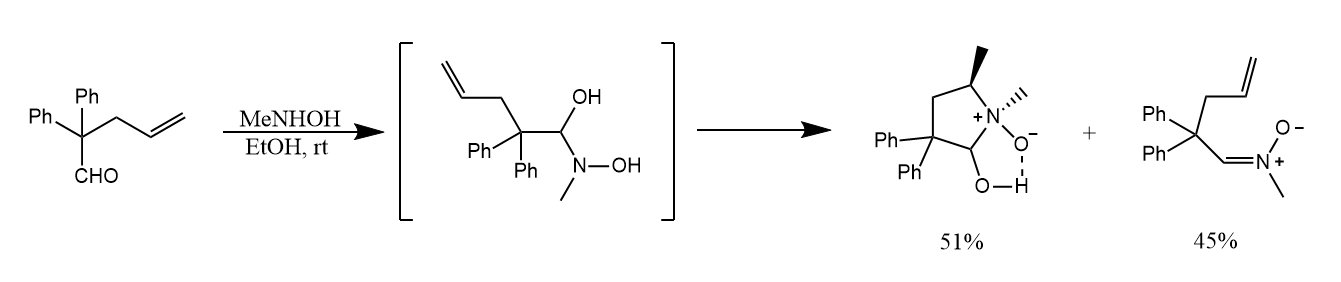
氮氧化物一般不稳定,在上面的反应中,氮氧化物被氢键稳定。如果逆Cope消除产生的氮氧化物可以被进一步转化,则逆反应可顺利进行。
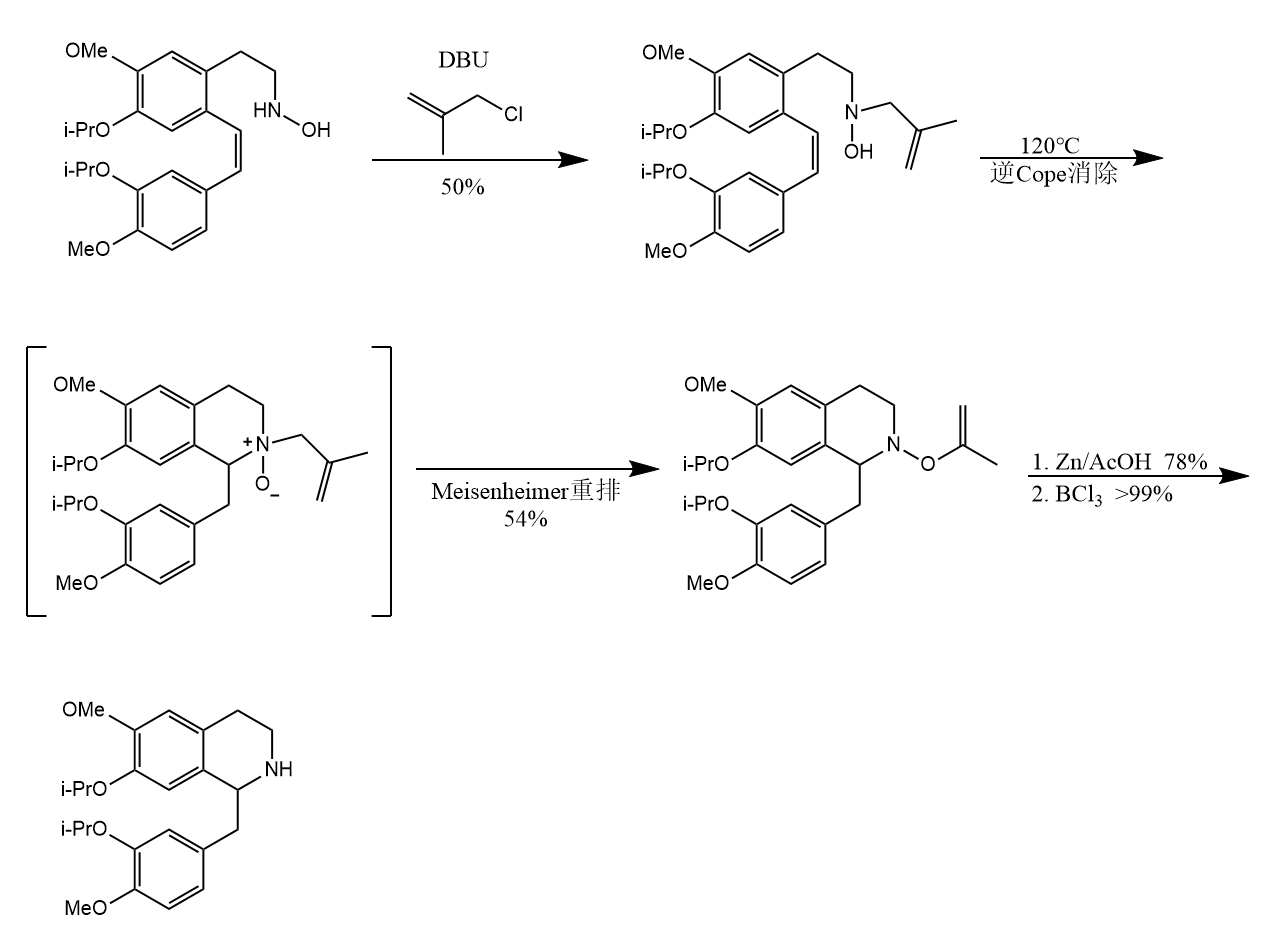
亚砜和硒氧化物受热可发生类似的顺式消除,例如通过羰基化合物的-亲电取代得到的-硒基化酮在氧化剂作用下生成硒氧化物,后者发生消除:
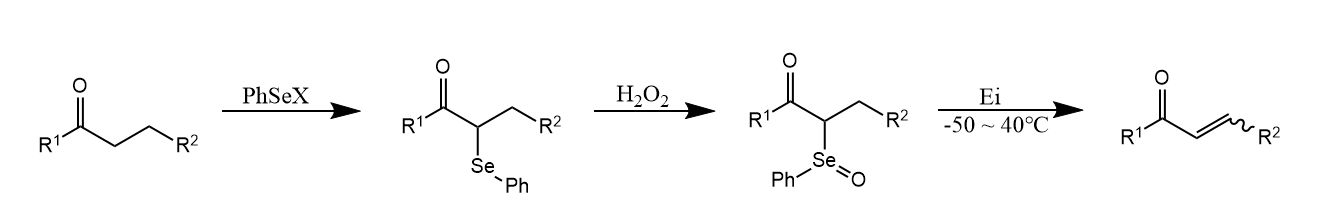
酯和黄原酸酯的热消除经历了一个六元环状过渡态,属于协同反应。
碱性条件下和醇反应生成,继而用碘甲烷处理,得到黄原酸酯,黄原酸酯的热解得到烯烃,该反应称为Chugaev反应。
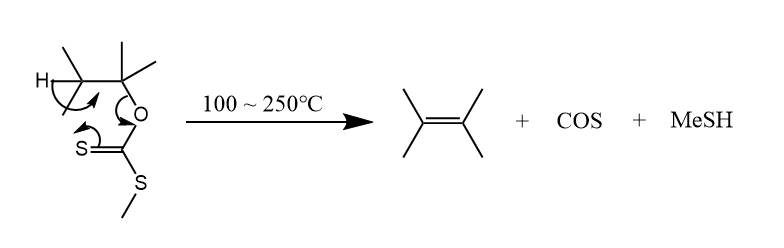
来看一个利用Chugaev反应的全合成的例子。
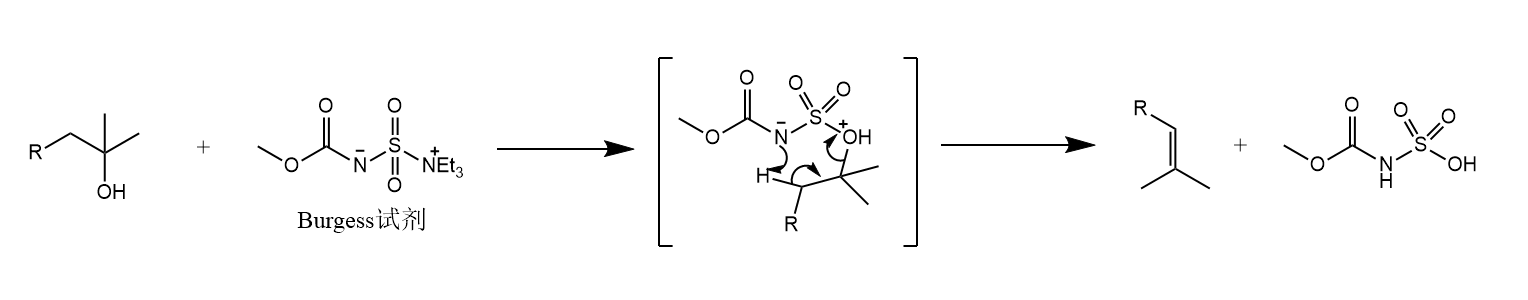
一些反应在碱催化下进行,例如Burgess试剂:
8.3 其他消除反应
羧酸和酰胺热解分别生成烯酮和烯酮亚胺,反应需要加热和脱水剂,酰胺相比羧酸需要更强的脱水剂。
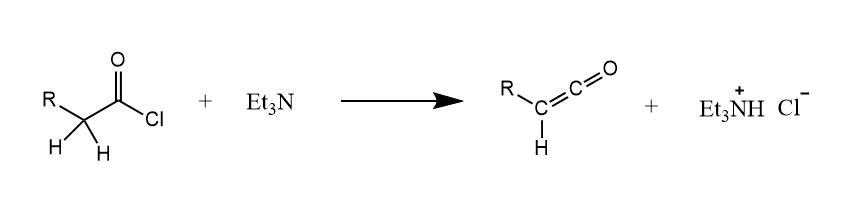
酰氯在碱作用下脱去生成烯酮,这是有机合成中制备烯酮的常用方法。
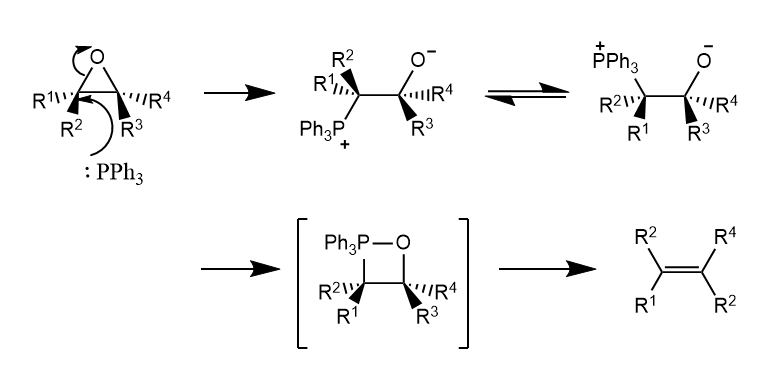
环氧化合物在三苯基膦作用下脱氧生成烯烃,反应具有立体专一性,该反应类似Wittig反应经历四元环过渡态顺式消除。
酮和对甲苯磺酰肼缩合得到的对甲苯磺酰腙在当量强碱(如烷基锂)作用下生成氮负离子中间体,后分解得到卡宾,再发生氢迁移得到烯烃,该反应称为Bamford-Steves反应;如果加入过量碱,会得到双负离子,脱去和后,生成烯基负离子中间体,最后被亲电试剂捕获生成烯烃,该反应称为Shapiro反应。
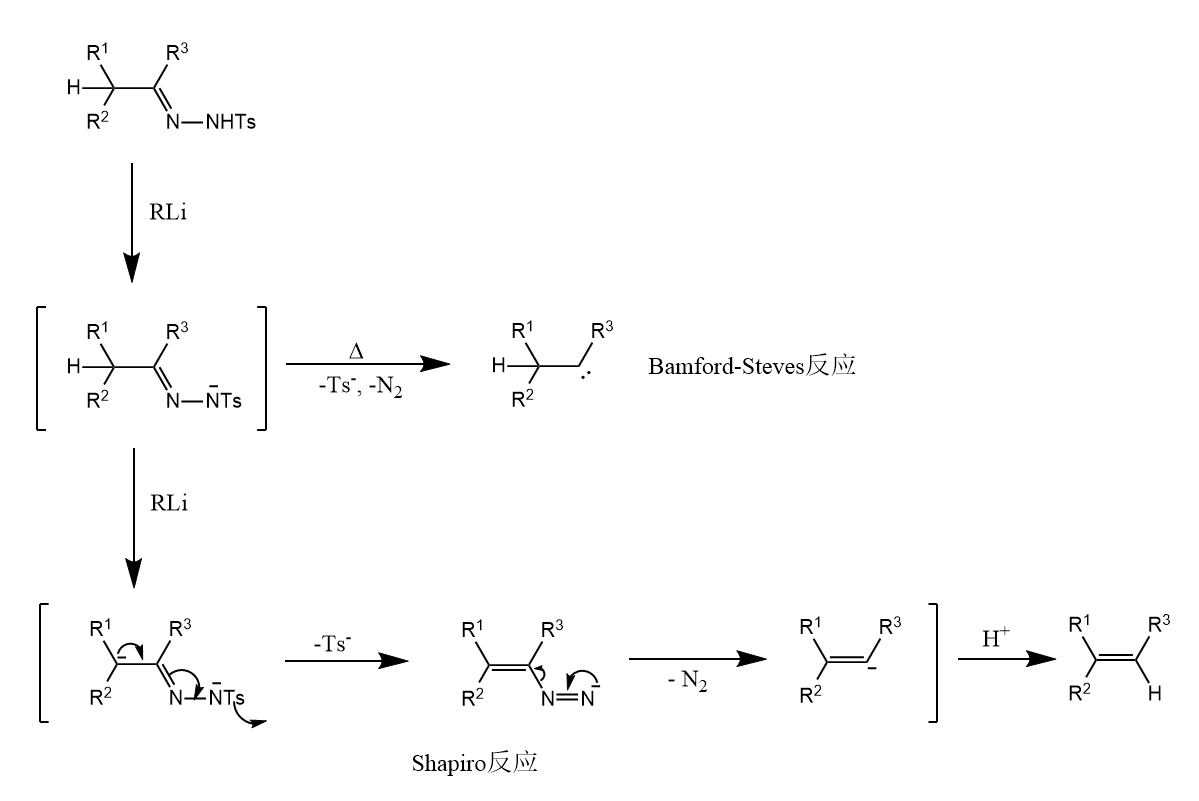
( 有些书把两个反应都当成Shapiro反应,认为是在不同条件下的不同机理,我觉得也算合理XD )
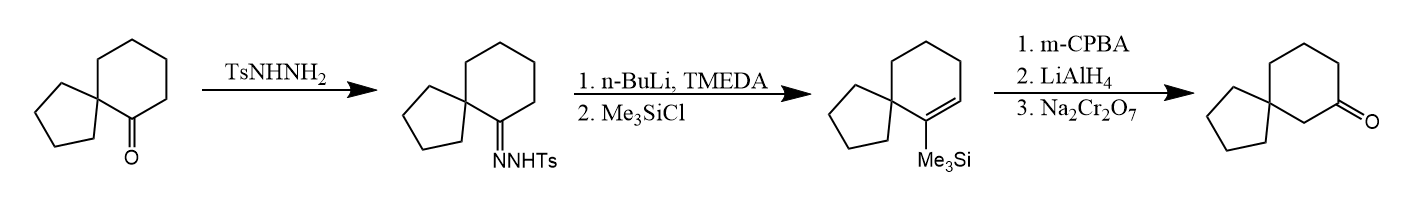
Shapiro反应的一个有趣应用是转移螺环酮化合物中羰基位置。
α-氯代-β-羟基酰胺/酯在二碘化钐作用下发生β-消除:
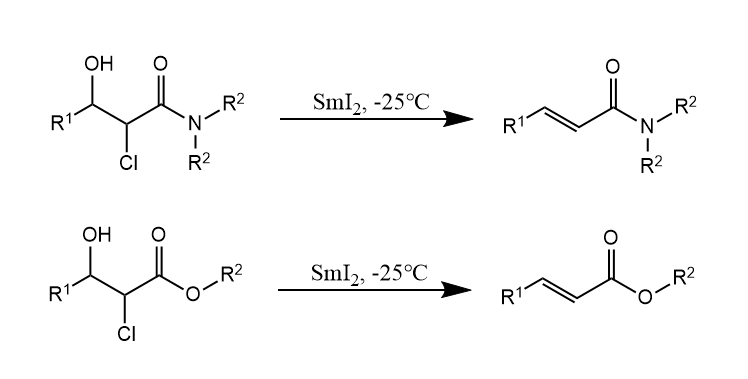
烯烃的构型来自六元环的椅式构象,因此得反式烯烃。
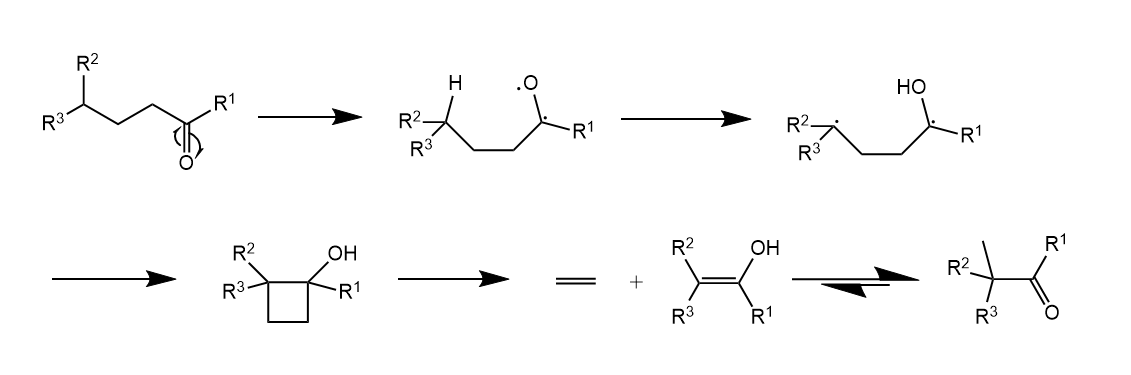
醛和酮若有γ-H,光照条件下能脱除烯烃,历程中经历双自由基中间体,并脱除乙烯。
总结
本章介绍了消除反应,过一遍加深印象。
努力画图…