《物理化学》章末总结10
第十章是电解池的有关内容。
第十章 电解与极化作用
使电能转变为化学能的装置称为电解池(electrolytic cell)。当一个电池与外接电源反向对接时,只要外加的电压大于该电池的电动势$E$,电池就接受外界所提供的电能,电池中的反应发生逆转,原电池就变成电解池。
实际上要让电解池连续正常工作,外加的电压往往要比电池的电动势大得多,这些额外的电能部分用于克服电阻,部分用于克服电极的极化作用。
10.1 分解电压
在电池上若外加一个直流电源,并逐渐增加电压直至使电池中的物质在电极上发生化学反应,这就是电解过程。
用$Pt$作为电极来电解$HCl$水溶液,记录并绘制电流-电压的曲线:
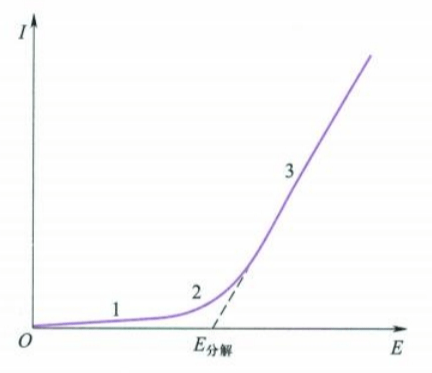
如图所示,电压逐渐增大的过程中,电流在一开始只是缓慢增加,但当电压增加到某一数值以后,曲线斜率急增,继续增加电压,电流就随电压直线上升。
分析这个过程,开始施加外电压时,电极表面开始产生少量的氢气和氯气,由于压力远远低于大气压,微量的气体无法离开电极自由逸出,这些少量的气体构成了一个原电池,它产生了一个与外加电压方向相反的反电动势(back electromotive force)$E_b$。
继续增大外电压,当$p_{H_2}$和$p_{Cl_2}$增加到等于外界大气压力时,电极上开始有气泡逸出,此时反电动势$E_b$达到最大值。
如果继续增大外加电压,电流就会和电势降($E_{外}-E_{b,max}=IR$)成正比增加,也就是图中上升的直线部分3。
将直线部分3反向延长到电流强度为零时所得电压为$E_{b,max}$,这是使某电解质溶液能够持续发生电解反应所需的最小外加电压,称为电解质溶液的分解电压(decomposition voltage)。
理论上,分解电压应当等于原电池的可逆电动势,不过实际上分解电压要更大,超出的部分是电极上的极化作用导致的。
10.2 极化作用
电解过程常是在不可逆的情况下进行的,即实际分解电压超过可逆电动势。
$$
E_{分解} = E_{可逆} + \Delta E_{不可逆} + IR
$$
式中$E_{可逆}$是指相应的原电池的电动势,即理论分解电压;$IR$项是由于电池内电阻引起的电势降;$\Delta E_{不可逆}$则是由电极的极化效应(polarization effect)所致的。
当电极上无电流通过时,电极处于平衡状态。当电极上有电流通过且逐渐变大时,电极反应的不可逆程度也越来越大,其电极电势值对于可逆值的偏离也越来越大。这种现象就称为电极的极化(polarization),偏差值称为超电势(或称过电位,overpotential)。
电极极化的原因是电极上发生反应时,需要克服反应步骤的势垒,就需要一定的推动力,表现在电极电势上就出现偏离。
可以把极化分为两类:浓差极化和电化学极化。下面分别介绍。
当金属电极发生反应时(金属的溶解/吸附),电极附近的溶液的离子浓度会发生变化,使得电极附近区域(其厚度不大于$10^{-2}cm$)溶液的离子浓度不同于本体溶液的离子浓度。此时就好像是把电极浸入一个浓度不同的溶液中一样,由这种浓度差引起的极化称为浓差极化(concentration polarization)。
以银电极为例,电极电势与溶液中的银离子浓度有关,我们可以计算不同浓度下电极电势的差:
$$
\eta_{阴}=(\varphi_{可逆}-\varphi_{不可逆})_{阴} = \frac {RT}{F} \ln \frac {m(Ag^+)}{m_e(Ag^+)}
$$
上式中$m_e(Ag^+)$为有电流通过时,电极附近的银离子质量摩尔浓度;$\eta_{阴}$为可逆电极电势与有电流通过时的电极电势的差值。
由此可见,阴极上浓差极化的结果是使阴极的电极电势变得比可逆时更小。相应的,可以证明阳极上浓差极化的结果是使阳极电极电势变得比可逆时更大。
为了使超电势为正值,我们人为规定:
$$
\eta_{阴} = (\varphi_{可逆}-\varphi_{不可逆}){阴} \[3mm]
\eta{阳} = (\varphi_{不可逆}-\varphi_{可逆})_{阳}
$$
即使忽略浓差极化,某些电解池的电解过程仍需要更大的电动势才能顺利进行,特别是当电极上产生气体的时候,实际所需电极电势与理论电极电势的差值会更大,这种现象称为电化学极化(electrochemical polarization)。
产生电化学极化的原因是,电极反应通常是分若干步进行的,这些步骤中可能有某一步反应速率比较慢,需要更高的活化能。
因此,每个电极的实际析出电势等于可逆电极电势加上浓差超电势和电化学超电势:
$$
\varphi_{阳,析出} = \varphi_{阳,可逆} + \eta_{阳} \[3mm]
\varphi_{阴,析出} = \varphi_{阴,可逆} - \eta_{阴}
$$
而整个电池的分解电压等于阴、阳两极的析出电势之差:
$$
E_{分解} = \varphi_{阳,析出} - \varphi_{阴,析出} = E_{可逆} + \eta_{阳} + \eta_{阴}
$$
测定超电势实际上就是测定在有电流通过电极时的电极电势,然后绘制电流与电极电势关系,得到极化曲线。
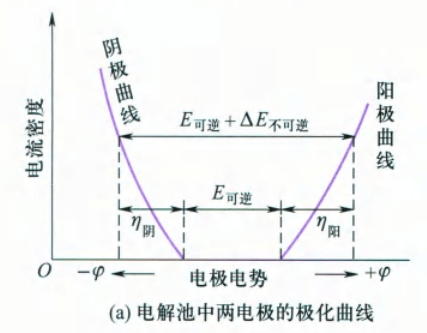
可见电解时电流密度越大,超电势越大,则外加的电压也要增大,所消耗的能量也就越多。
对于原电池同样可以绘制极化曲线:
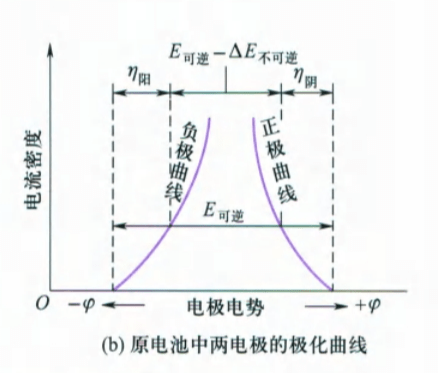
发现随电流密度增大,原电池的电动势逐渐减小,所能做的电功也逐渐减小。
从能量消耗的角度看,极化作用对于原电池和电解池都是不利的,必须给电极适当的反应物,使电极上的极化减小或限制在一定程度内,这种作用称为去极化作用(depolarization),这种外加的物质则叫去极化剂(depolarizer)。
氢超电势是各种电极过程中研究的最多的,但是仍存许多问题不很清楚。1905年,Tafel提出了一个经验式表示氢超电势与电流密度的定量关系:
$$
\eta = a + b\ln (j/[j])
$$
式中$j$为电流密度,$[j]$为电流密度的单位,$a,b$为常数。
从Tafel公式可以看出,超电势与$\ln j$成线性关系,这一点在电流密度很小时不成立,但是在正常范围内适用。
Tafel公式的推导在此处略去。
10.3 电解时电极上的竞争反应
不难得到,在阴极上,还原电势越正者,其氧化态越先还原;在阳极上,其还原电势越负者,其还原态越先氧化。此处的电势指的是析出电势,即考虑超电势的影响。
超电势的存在会增加能量消耗,但是也正因为超电势存在,才使得某些本来在$H^+$之后在阴极上还原的反应,也顺利地先在阴极上进行。例如活泼金属钠,可以用汞电极使$Na^+$还原,生成钠汞齐而不会放氢气(因为氢气在汞上的超电势很大)。
如果溶液中有多种不同的金属离子,它们分别具有不同的析出电势,可以控制外加电压的大小使金属离子分步析出。例如假设金属离子还原过程中阳极电势不变,设金属离子的起始和终了活度分别为$a_{M^{z+},1}$和$a_{M^{z+},2}$:
$$
\Delta E_{阴} = \frac {RT}{zF} \ln \frac {a_{M^{z+},1}}{a_{M^{z+},2}}
$$
设$\frac {a_{M^{z+},1}}{a_{M^{z+},2}}=10^{7}$时,离子的浓度降低为原浓度的千万分之一,离子基本分离干净。那么对于一价金属离子,$\Delta E_{阴} =0.4V$;对于二价金属离子,$\Delta E_{阴} = 0.2V$。
10.4 金属的电化学腐蚀、防腐与金属的钝化
金属表面与周围介质发生化学反应及电化学作用而遭受破坏的现象,通称为金属腐蚀。本章主要介绍电化学腐蚀(electrochemical corrosion)。
电化学腐蚀的原理是金属与其他金属以及其他介质相接触,形成一个原电池,并进行原电池的化学作用,使金属被腐蚀。
阳极上一般发生的都是金属的溶解反应,而阴极上最常见的反应包括析氢腐蚀和耗氧腐蚀等。
-
析氢腐蚀:
$$
2H^+ + 2e^- \rightarrow H_2(g) \[3mm]
\varphi_1 = -\frac {RT}{2F} \ln \frac {a_{H_2}}{a^2_{H^+}}
$$ -
耗氧腐蚀:
$$
O_2(g) + 4H^+ + 4e^- \rightarrow 2H_2O \[3mm]
\varphi_2 = \varphi^{\ominus}{O_2|H^+,H_2O} - \frac {RT}{4F} \ln \frac 1{a{O_2}\cdot a^4_{H^+}}
$$
$\varphi_2$比$\varphi_1$大得多,说明有氧气存在时金属的腐蚀会更严重。
金属的防腐常用以下几种方法:
- 非金属保护层。
- 金属保护层。用耐腐蚀性的金属或合金覆盖在被保护的金属表面,如果使用阳极保护层(比被保护金属更活泼的金属),即使保护层破损,两种金属形成原电池,也是保护层金属优先损坏。
- 电化保护。包括阴极电保护法和阳极电保护法,阴极电保护为牺牲阳极保护阴极金属;阳极电保护则是通过金属钝化来保护金属。
- 加缓蚀剂保护。
金属钝化可以通过强氧化剂钝化或者施加电流钝化,如果我们采用特定的设备使金属(以铁为例)的电势逐步升高,同时观察电流变化,就可以绘制极化曲线:
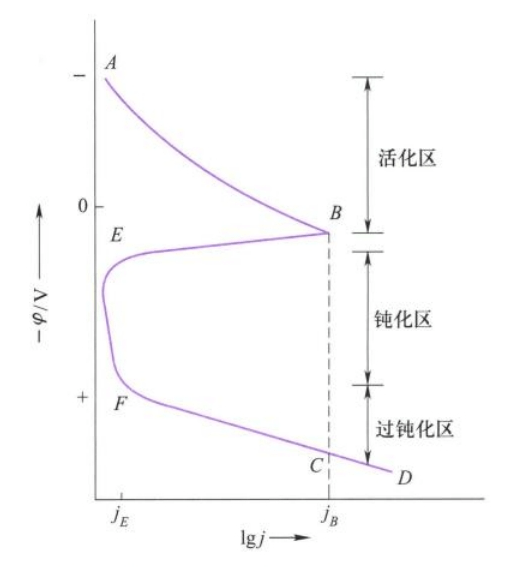
我们可以看出,在B点前,铁正常的发生氧化反应,但是在B点后,电流密度随电势的增加迅速降低到很低的数值,即金属发生钝化。EF段电流始终较小,此时的电流称为钝态电流。如果电势继续增大,电流又开始增加,表示阳极又发生了氧化。
10.5 化学电源
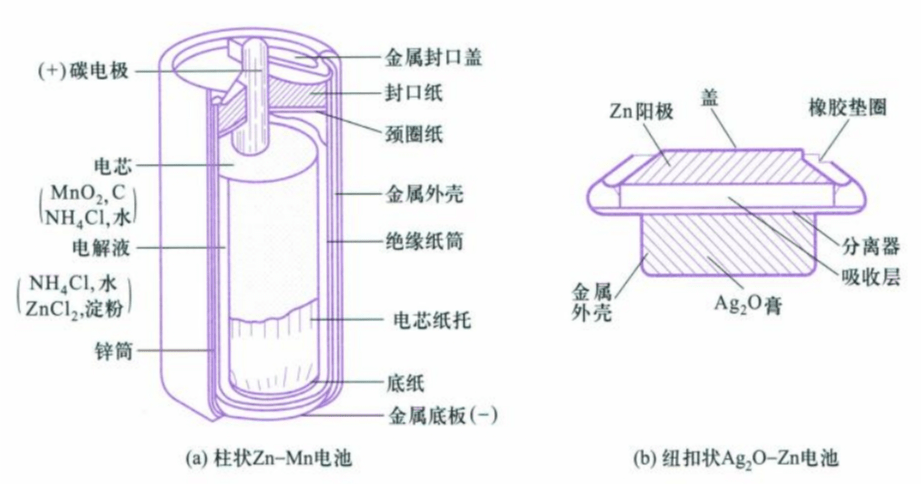
化学电源是将化学能转化为电能的实用装置,按照使用特点可以分为一次电池(只能使用一次)和二次电池(可以反复充放电的电池)。
常见的一次电池有$Zn-C$电池、$Zn-Mn$电池、$Ag_2O-Zn$电池等;常见的二次电池有铅酸电池、$Ni-Cd$电池等。
直接燃烧燃料会有大量能量以热能形式散失,如果能够把燃料燃烧的化学反应组成原电池,其效率就会大大提高。这种以燃料作为能源,将燃料的化学能直接转换为电能的装置称为燃料电池(fuel cell)。
10.6 电有机合成简介
如果把有机化合物的合成反应安排在电解池中进行,那么称为电有机合成反应。
电化学合成通常在常温下进行,产品纯度高,可以更好地选择所得产品,但是目前仅有少数具有应用价值的反应应用到工业规模的生产中。
总结
电解池和原电池的内容有很多对应之处,本章的重点主要是极化作用的理解。