《有机合成-切断法》章末总结4
本章为最后一章,作为本书的总结,介绍立体化学和合成的通用策略。
1 立体选择性
立体化学在合成中是非常重要的一部分,比如有机化合物的生物性能取决于它们的立体化学结构,许多药物、杀虫剂、昆虫信息素、调味剂等等分子都证实了这一点。
合成中的立体选择性调控非常重要,但是往往又非常复杂,本书只讨论一些基础的内容。
对于对映立体异构体,不能用常规方法来分离,需要用手性拆分方法,本书对这方面讨论内容较少,此处略去。相比与合成后再分离,立体专一性反应是我们更喜欢的方案,可以直接生成专一的立体化学产物。
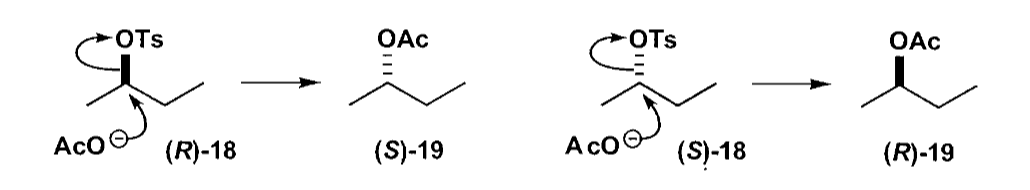
最简单的例子是$S_N2$反应的构型反转,可能会导致手性发生翻转。
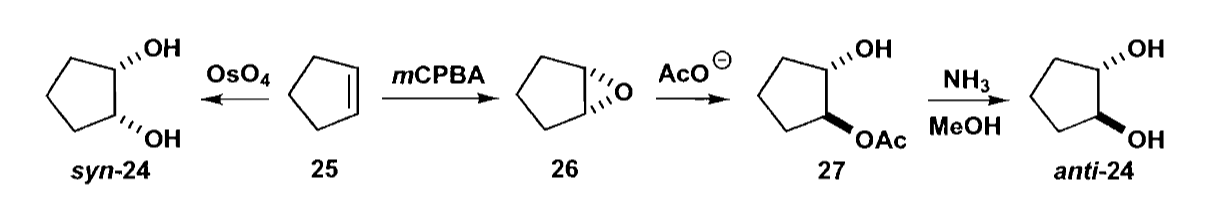
另一个例子是烯烃的双羟化,四氧化锇作用下,烯烃发生双羟化反应生成顺式邻二醇。而环氧化反应被进攻开环后则会得到反式二取代。
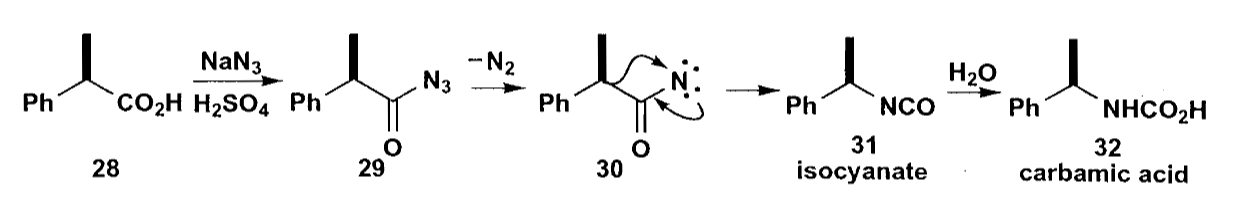
再来一个例子,一些重排反应会保留重排基团的构型,如Curtius重排等存在异氰酸酯中间体的重排。
除了立体专一性,还有稍弱一些的立体选择性反应,分子虽然有两种可能的反应途径,但是在立体化学上具有一定的选择倾向。
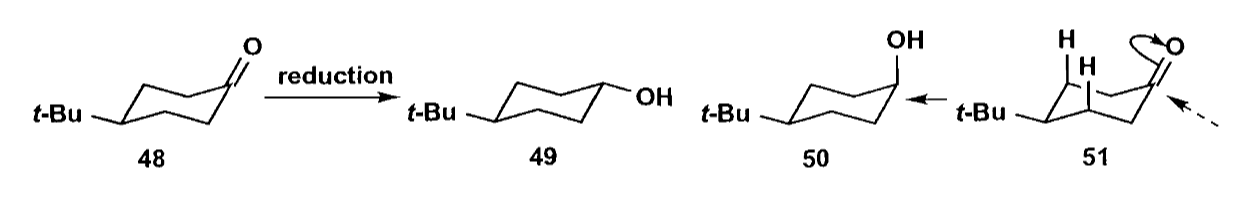
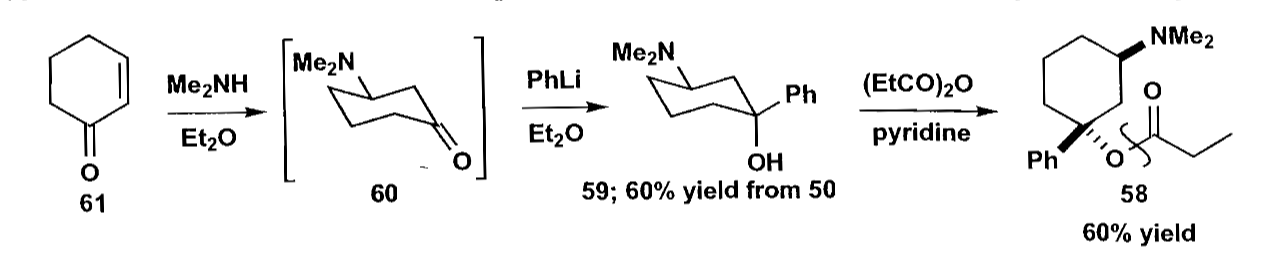
如上图的还原反应,由于1,3-二直键的位阻影响,大位阻的还原剂主要得到羟基处于直立键的醇(化合物50)。
对于立体化学不同的分子,在进行后续的立体专一性反应步骤时也可能会有影响。
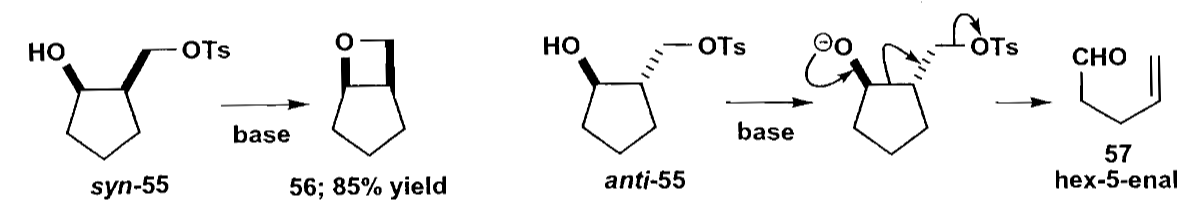
如上图中的顺式化合物,由于官能团间离得比较近,因此可以发生$S_N2$成环;但是反式化合物的官能团距离太远无法成环,因此会开环重排。
环状化合物的立体化学需要特别讨论一下,对于饱和六元环上的手性中心,可能可以进行构象控制,如环己酮类化合物的加成,大位阻的亲核试剂倾向于从e键方向进攻。
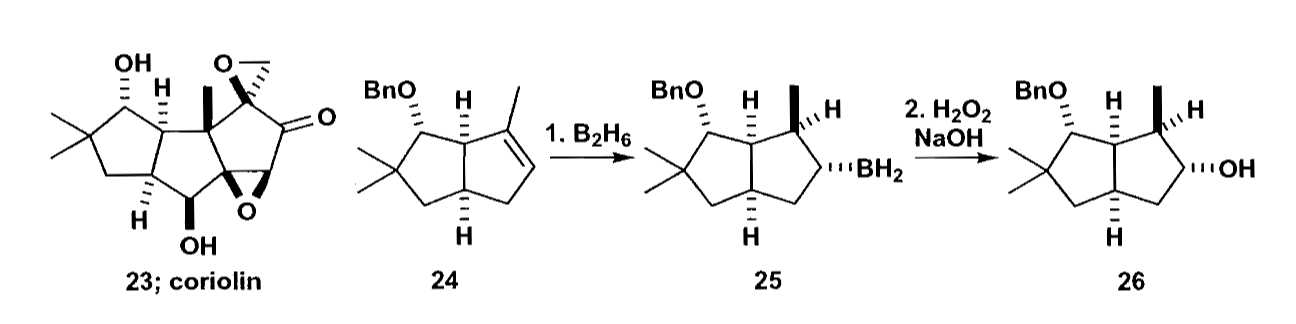
折叠式的稠环化合物会体现出“书页型”的构象,就像是一本打开的书一样,“书内侧”是位阻大的一侧,“书外侧”则是位阻小的一侧,反应会倾向在位阻小的“书外侧”进行。

两个六元稠环的构型不那么容易分析,当两个环均为椅式构象时,仍有环内和环外的差别,反应趋向从外侧进行。
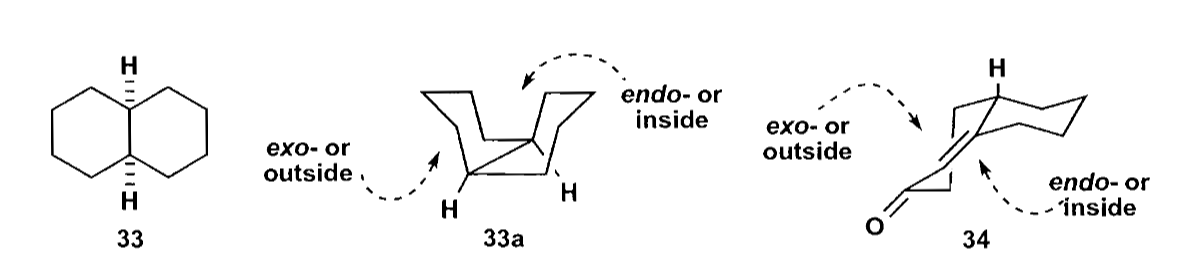
看一个例子:
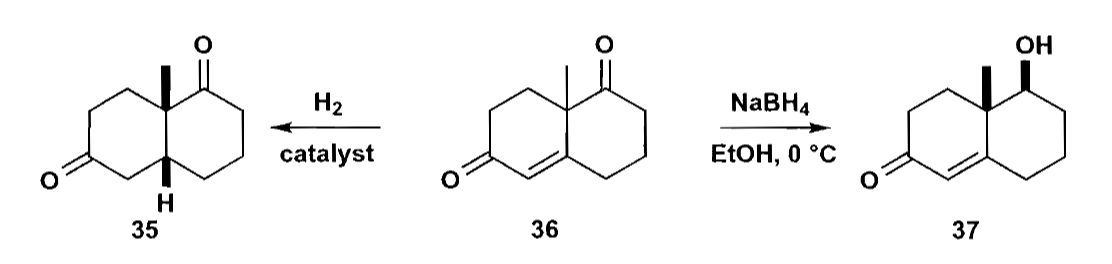
对于上图反应中的化合物36,在环连接处直立键甲基和另外一个环相比位阻小,因此还原的H与甲基为顺式;但是如果试剂去进攻环上的羰基,是可以从底面进攻的。
最后以Prelog-Djerassi内酯为例综合分析一下合成中的立体化学,Prelog-Djerassi内酯是合成大环内酯类抗生素的一个重要中间体,它有一个六元环内酯和一个孤立的羧酸,同时还有四个手性中心。
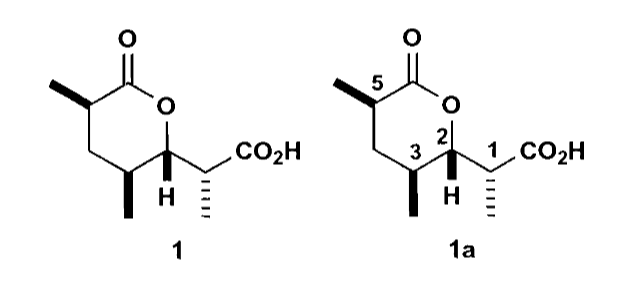
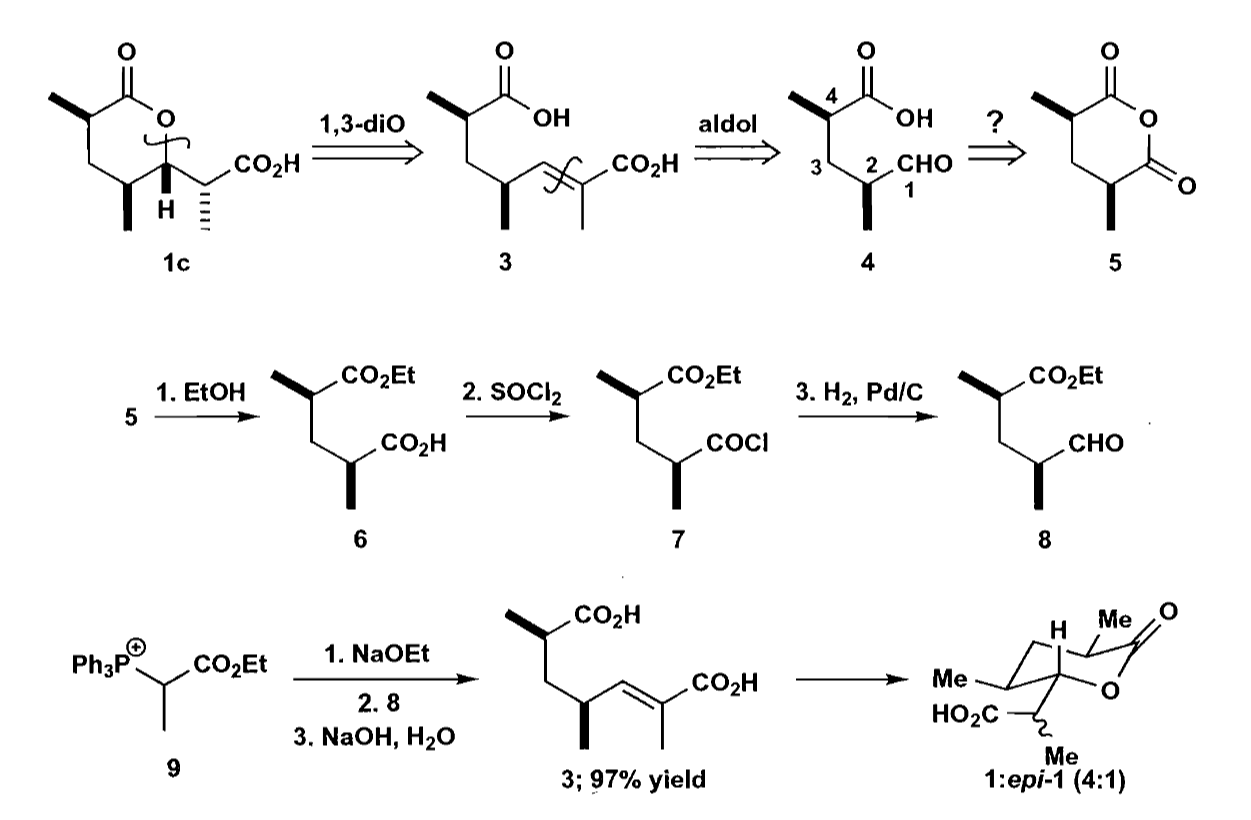
支链上的羧酸可以通过羟醛缩合反应切开,从而把原料转化为1,5-二羰基化合物,进而转化为环状酸酐,利用酸酐来区分两个羰基。
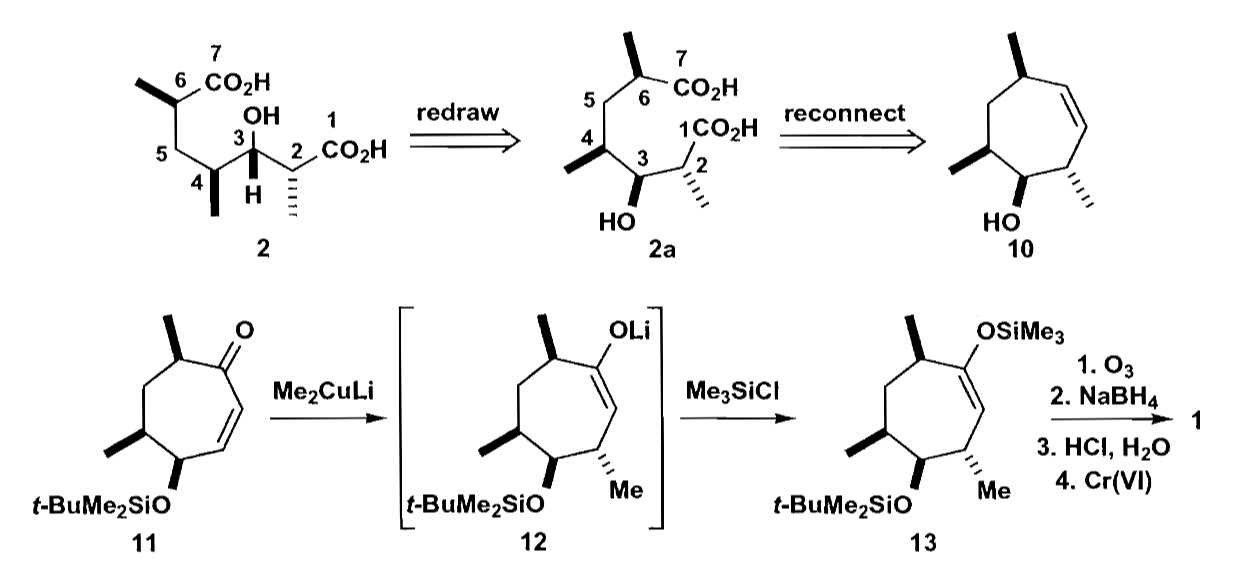
当然还有别的切断方法,例如通过七元环来合成,并使用铜试剂对烯酮在大位阻基团的反面加成引入甲基。下图中最后的化合物1即为目标的Prelog-Djerassi内酯。
2 通用策略
通用策略即一般合成中均可使用的普适性好的策略,或者你可以认为是合成的基本思路,本节把书中提到的通用策略作了一个简要的整理总结。
先从切断开始,俗话说好的开始是成功的一半,对于化合物分子合理的切断能够为接下来的合成提供巨大便利。各种分子有不同的切断思路,但是有一些基础的共通性原则如下。
- 在分子中间切断,把一个分子切断为合理的两半分子要比在末端切开一点点要好。
- 在侧链处切断,这样就可以得到简单的直链起始原料。
- 切断时如果保留分子对称性通常会非常有帮助。
- 如有多条合理路线,应选择步骤尽量短,起始原料易得的路线。
当然上述策略也不是一定都要满足,具体化合物的合成路线应根据情况合理设计。
其次,考虑到羰基化合物在有机合成中的重要地位,我们有必要再次讨论一下羰基切断的一般策略。
看一个例子,比较一下不同合成路线的优劣在哪里。
对于下图中的螺环化合物34,一个自然的想法是把双键切开,转化为羟醛缩合,然后根据1,4-二羰基关系转为$\bold d^2 + \bold a^2$。
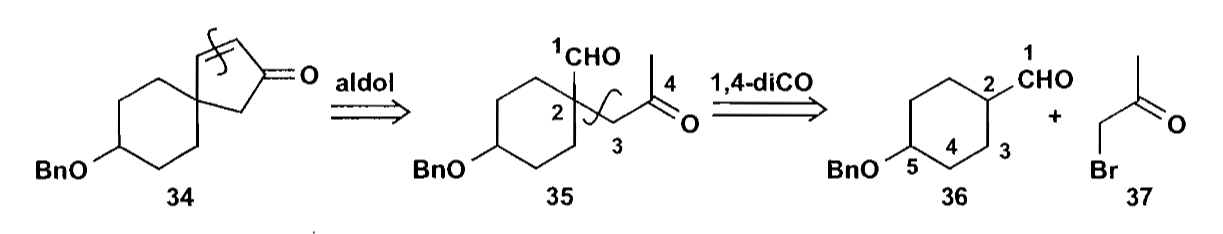
上述方案看似可行,但是化合物36在合成时遇到了各种困难,我们不妨探索一下其他更简单的方案。
另一个非常相似的切断是把上图的反应性倒转过来,并且改变官能团以减少副反应发生。
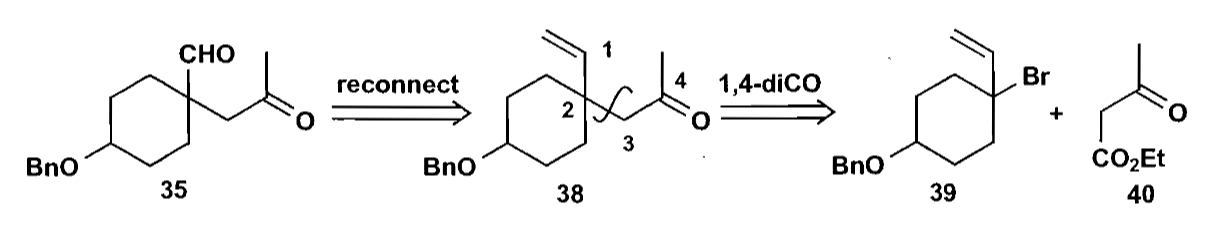
但是这个方法也不行,因为化合物39作为被进攻的一方有一个显著的缺点:位阻太大,在这种情况下,化合物39受到亲核进攻时,亲核试剂会从位阻小的烯丙基一侧进攻,无法得到我们想要的产物。
这时,我们可以从切断化合物38的侧链入手。
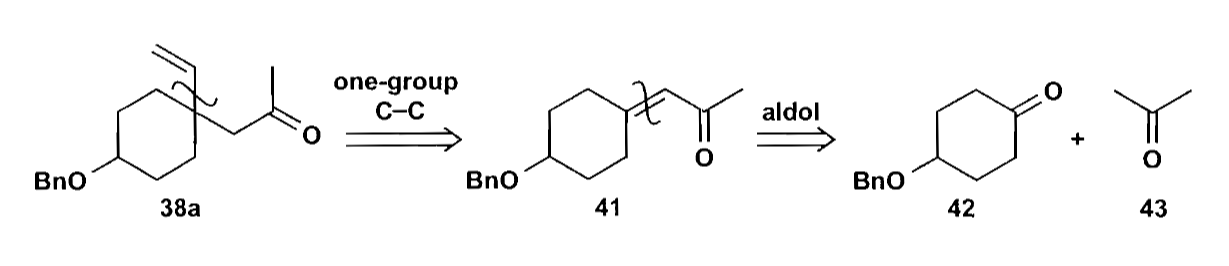
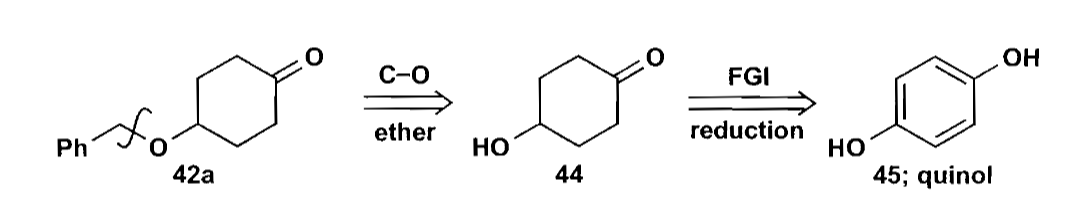
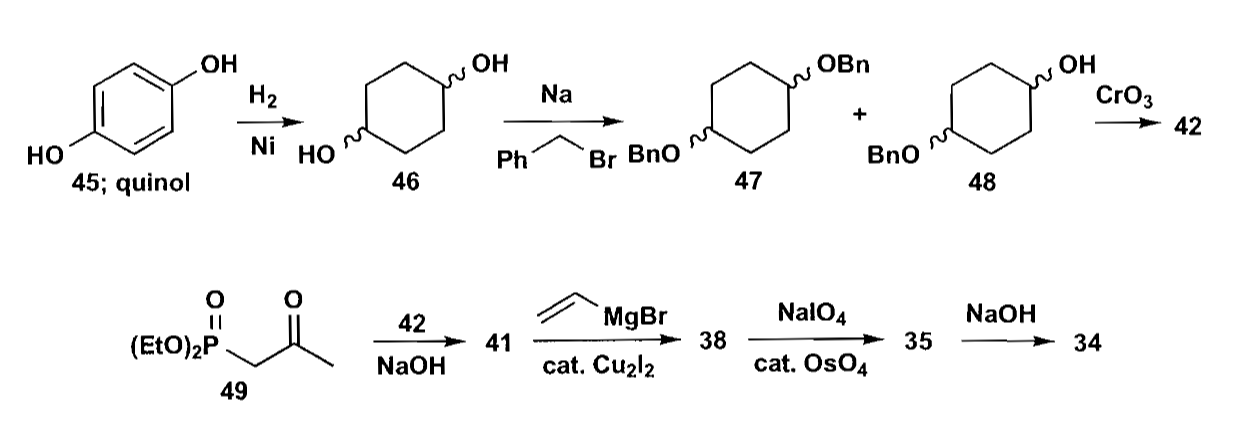
化合物42进一步拆分,可以得到简单的对苯二酚底物,接下来的问题是如何区分两个酚羟基。
答案是:不必刻意区分,因为还原后苄基化的反应基本符合统计学,也就是下图中的单醚48:二醇46:二醚47=2:1:1,同时这三者还易于分离,分离出的46,47可以循环利用,所以最终的产率还不错。
最后用HWE反应连接42和43,用铜催化的格氏试剂完成共轭加成,氧化后完成关环。
可见我们在上述化合物的合成中运用了一些最开始提及的原则,但也有不一样的切断思路。下面再看一个环状化合物合成的例子。
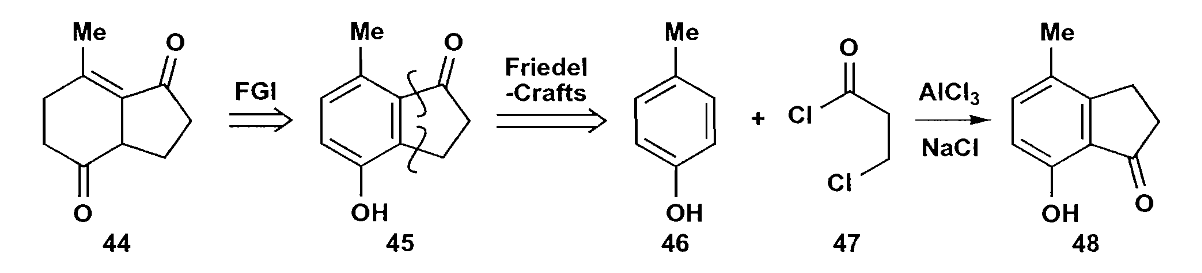
对于化合物44来说,一个合理的想法就是先把左环转化为苯环,然后利用亲电取代来构建右侧五元环。但是上图中路线的区域选择性有问题,酰氯一端会结合到给电子能力更强的羟基邻位,生成化合物48。
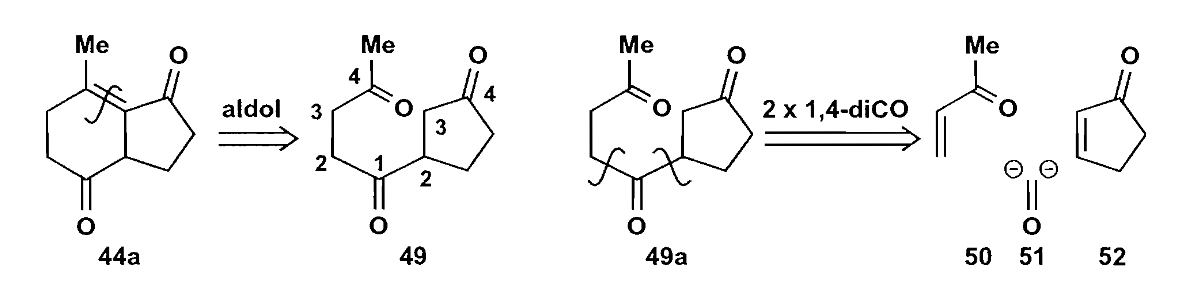
我们可以把环切开,用羰基化合物的合成思路来考虑,不难发现双键切断后的两个1,4-二官能团关系,然后可以利用一个$\bold d^1$合成子实现反应。
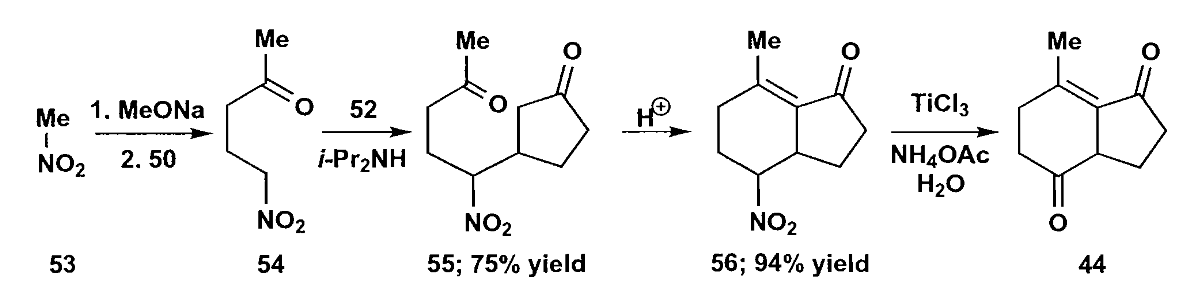
一碳合成子的选择很重要,这里用的是硝基甲烷,加成后用$TiCl_3$水解即得目标酮。
最后是一个长步骤合成时有用的策略:会聚法(convergence)。对于一个10步的线性合成,即使每一步的收率都达到90%,但是总收率也会在35%以下;然而,如果分别合成初级原料,然后合到一起,这样总产率将会提高到43%。这就是会聚法的好处,这也解释了我们在前文提到的“从中间切断”和“切断侧链”的好处所在。
最后介绍化合物Methoxatin的合成,方法不止一种,这里只介绍Corey的合成路线。
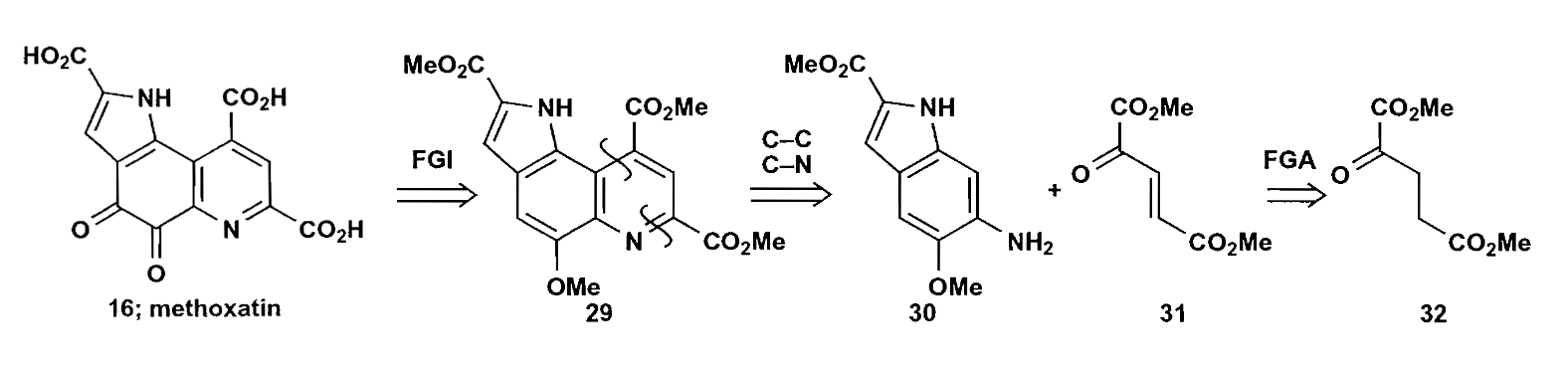
Corey的思路是以苯环为核心,构建其他相邻的两个环,第一步是切断吡啶环获得化合物30+31。接下来根据Fischer吲哚合成法切断30得到更基础的原料。
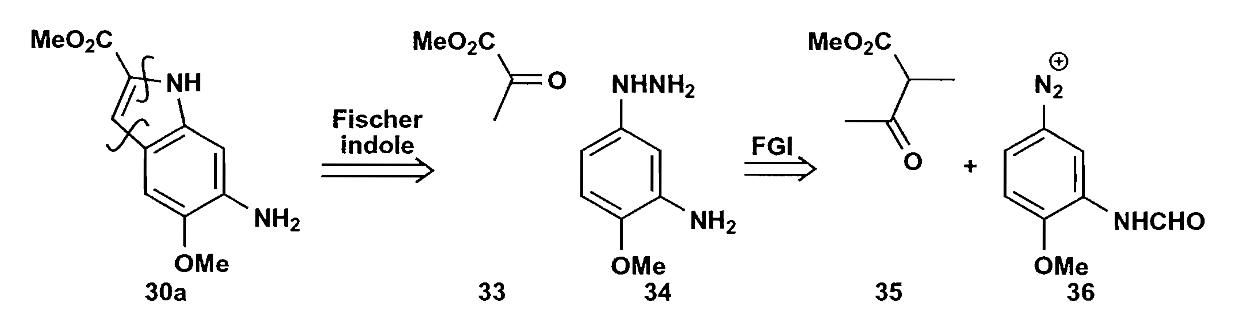
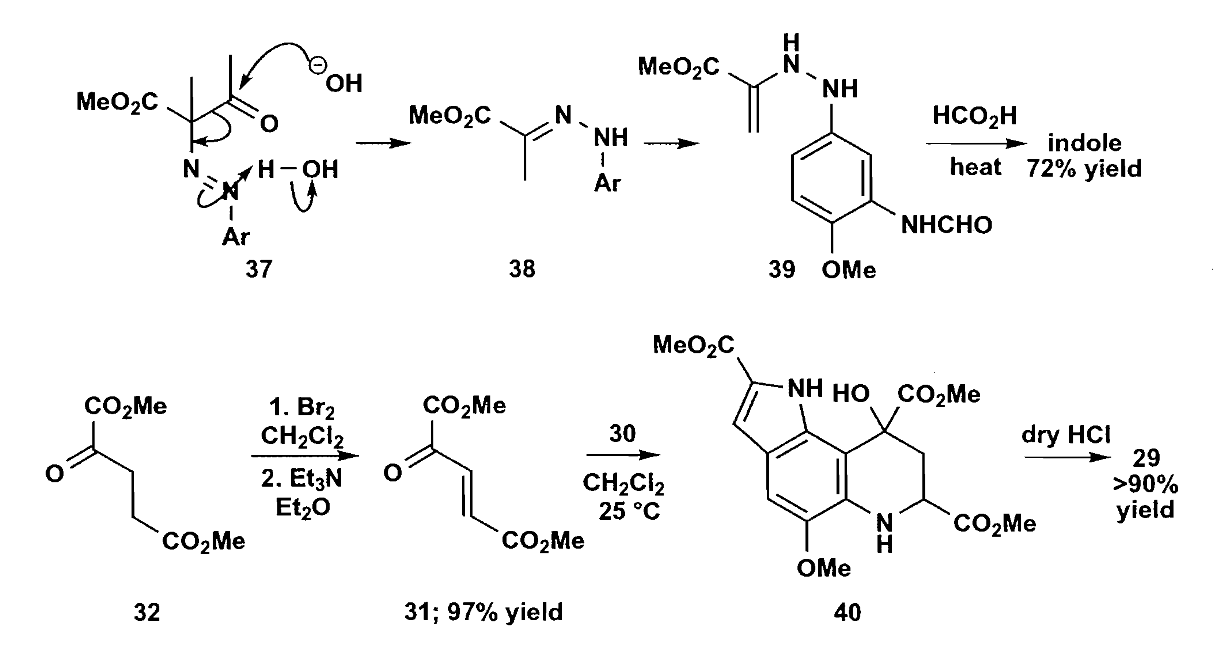
注意这里吲哚环的构建,选用的是芳香重氮盐和β-酮酯(Japp-Klingermann反应),由于位阻的影响,该反应具有非常高的区域选择性。制得的化合物30和31再反应,在干燥$HCl$作用下完成芳构化得到化合物29,收率很不错。最后,化合物29用$Cr(Ⅵ)$很容易就可以氧化为目标化合物Methoxatin。
总结
那么到此为止,本书的内容就结束了,虽然这本书不论是原版还是译版都可以说是“破绽百出”,但是我认为它仍是一本不错的有机合成入门书籍,书中的内容都是基础有机合成,非常通俗易懂,但是也注定了它内容比较过时,缺乏很多深入的细节讨论,更深的内容还是交给《策略与控制》吧。
《策略与控制》一定要看英文原版=.=