《中级有机化学》章末总结9
第九章为重排反应,本章主要是重排反应的罗列。
第9章 重排反应
9.1 重排到缺电子性碳原子上
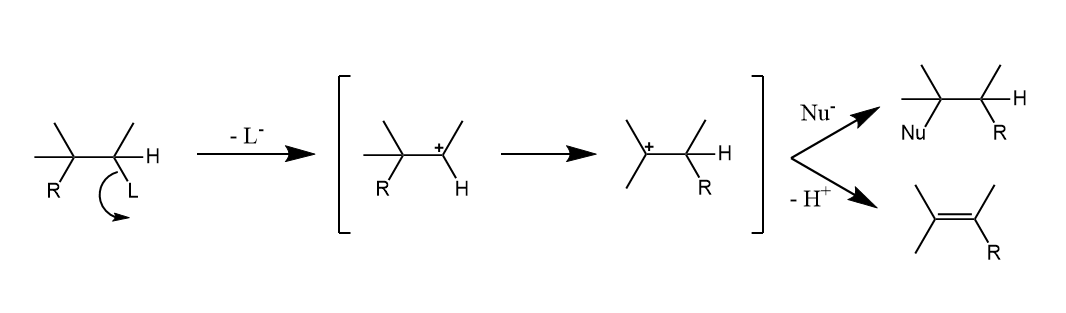
氢原子或R基团带着一对电子迁移到邻位碳正离子或带部分正电荷的碳原子上的反应是最常见的一种重排反应,通常迁移基团的构型在迁移后保持不变。
重排反应大致可以分为三类:酸性条件重排到空p轨道、碱性条件下重排到$\sigma^$轨道、碱性条件下重排到$\pi^$轨道。三种类型都是以轨道重叠为基础的。
后面的内容都是罗列反应,重要的反应和有意思的内容会特别讨论,一般反应都是提一嘴就过。
Wagner-Meerwein重排。在质子酸或Lewis酸存在下,碳正离子中间体发生的氢或烃基的1,2-迁移,生成另一种碳正离子。
Wagner-Meerwein重排经历一个二电子三元环状过渡态,迁移的立体化学是同面迁移,迁移具体的构型保持。
Wagner-Meerwein重排的驱动力是得到更稳定的碳正离子,或降低环张力,有时反应历程中会经过更不稳定的碳正离子中间体,但是总的反应在能量上也是有利的,如:
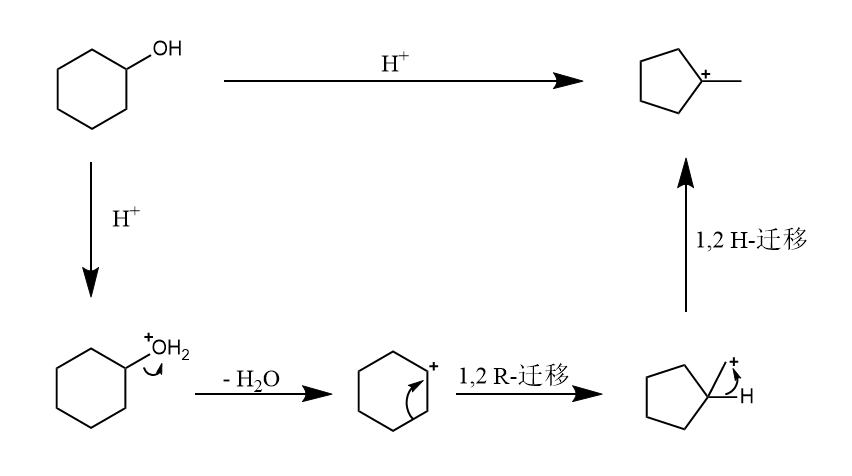
当有两个基团都可以发生迁移时,首先考虑立体化学要求,即同面迁移,然后考虑基团迁移能力,基本按照给电子能力排序,越大者越先迁移,但H由于位阻极小,最优先迁移。
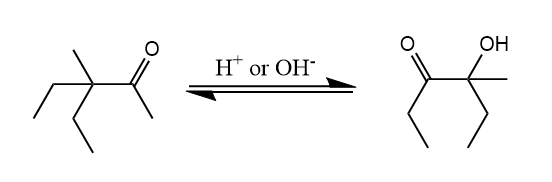
频哪醇重排。邻二醇在酸性条件下重排生成酮,重排的驱动力是碳正离子转化为更稳定的氧鎓离子。
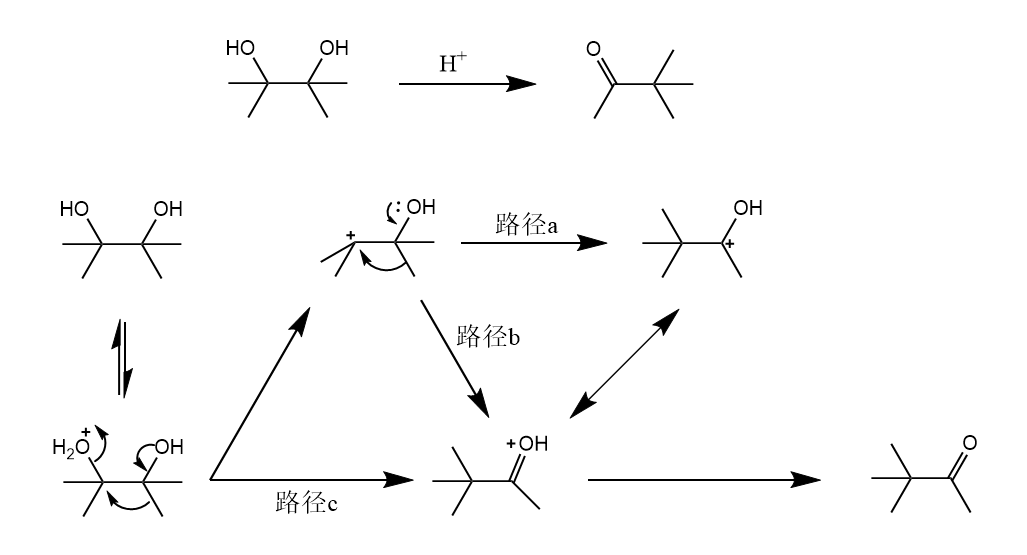
邻二醇的哪个羟基先被质子化取决于生成的碳正离子的稳定性,反应条件的改变也能影响重排的区域选择性:
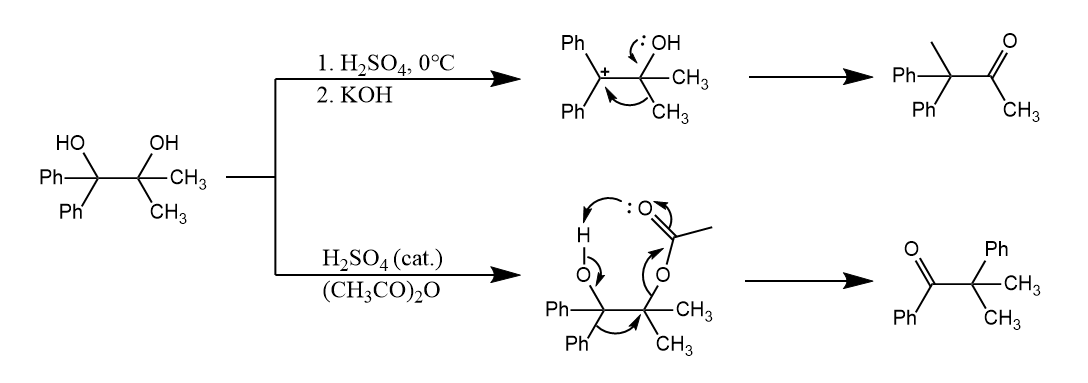
环状分子的反应要更多的考虑轨道方向性,满足轨道的有效重叠。
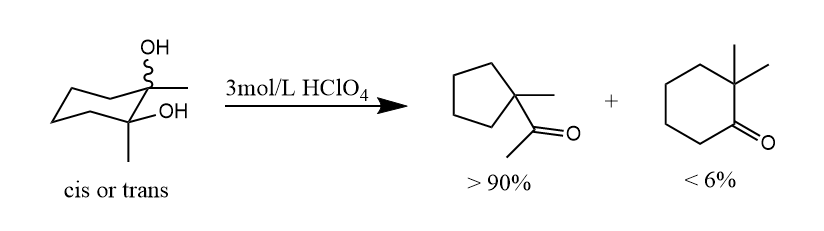
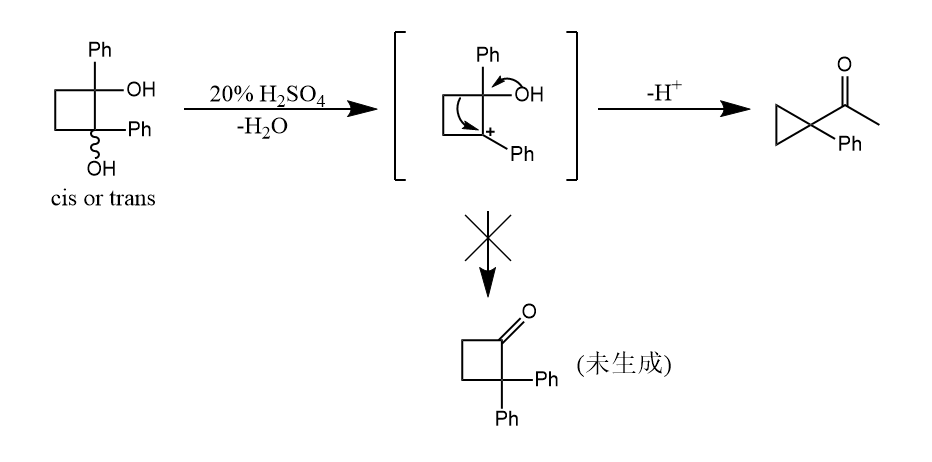
看一个环状分子反应的特例,如下所示的取代环丁二醇优先迁移的亚甲基而不是苯基,因为环外双键的环丁酮较不稳定。
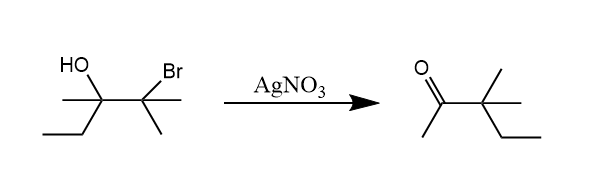
其他经过β-羟基碳正离子中间体的重排反应称为半频哪醇重排。
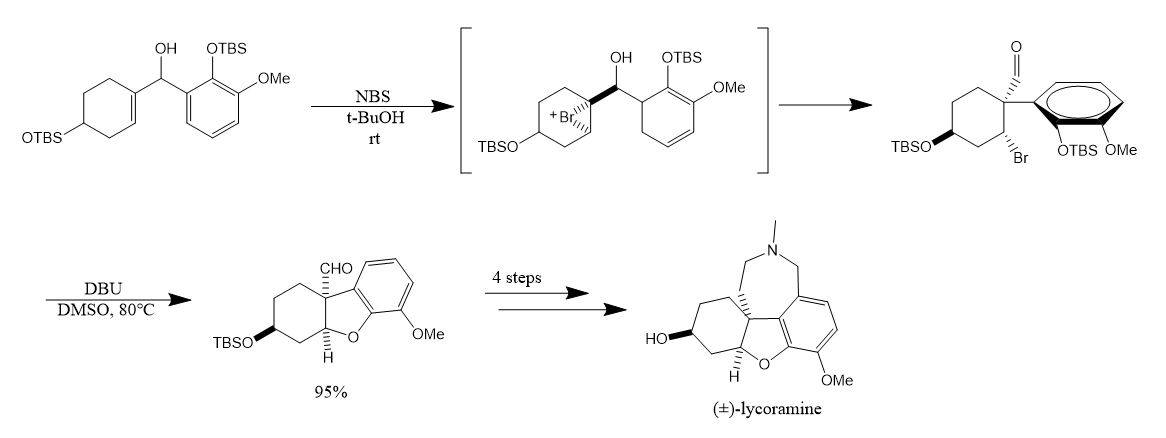
在生物碱lycoramine合成中应用的半频哪醇反应:
Tiffeneau-Demjanov重排。频哪醇重排的变形,由β-醇胺重叠化得到β-羟基重氮盐的半频哪醇反应。
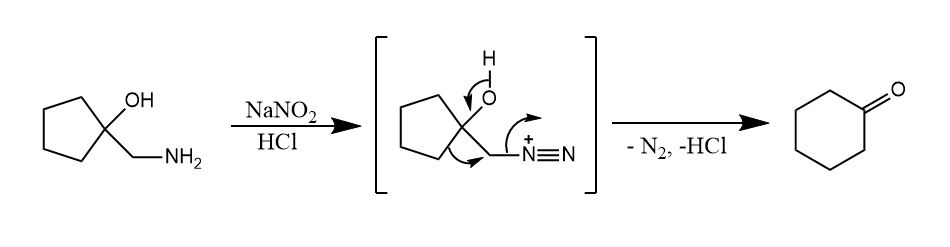
安息香重排。α-羟基羰基化合物在酸或碱的作用下重排,生成另一种α-羟基羰基化合物。注意该反应和安息香缩合不是一个反应。
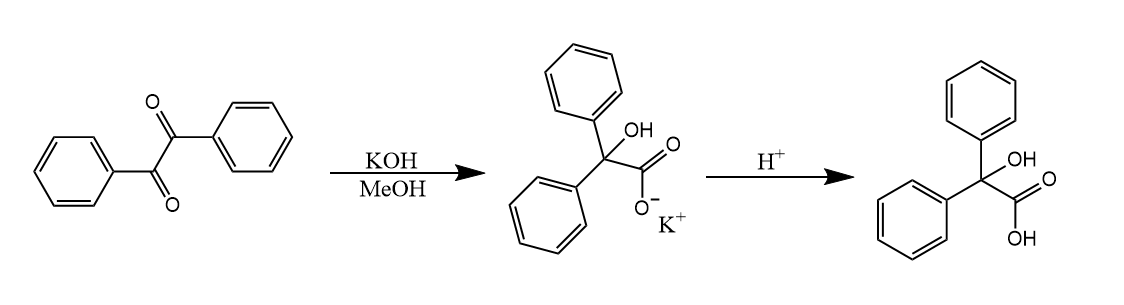
二苯乙醇酸重排。邻二羰基化合物在碱性条件下重排成α-羟基酸,这个反应的名字来源自反应生成的产物。
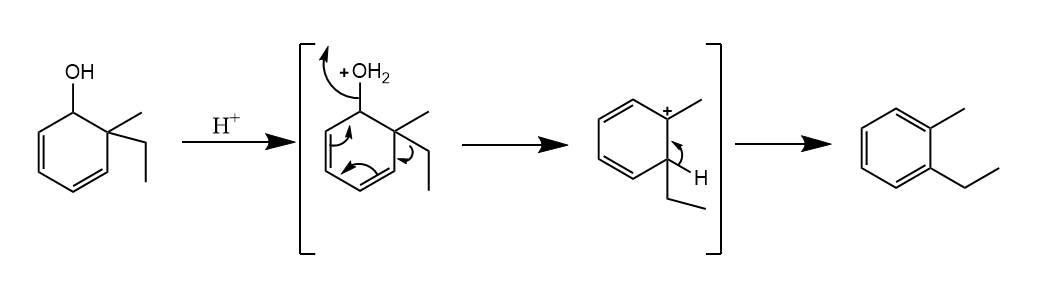
环己二烯酮-酚重排。6,6-二烷基取代的环己-2,4-二烯酮和4,4-二烷基取代的环己-2,5-二烯酮在强酸介质中发生1,2-烷基重排,生成酚类化合物。听起来有点绕,直接看反应吧。
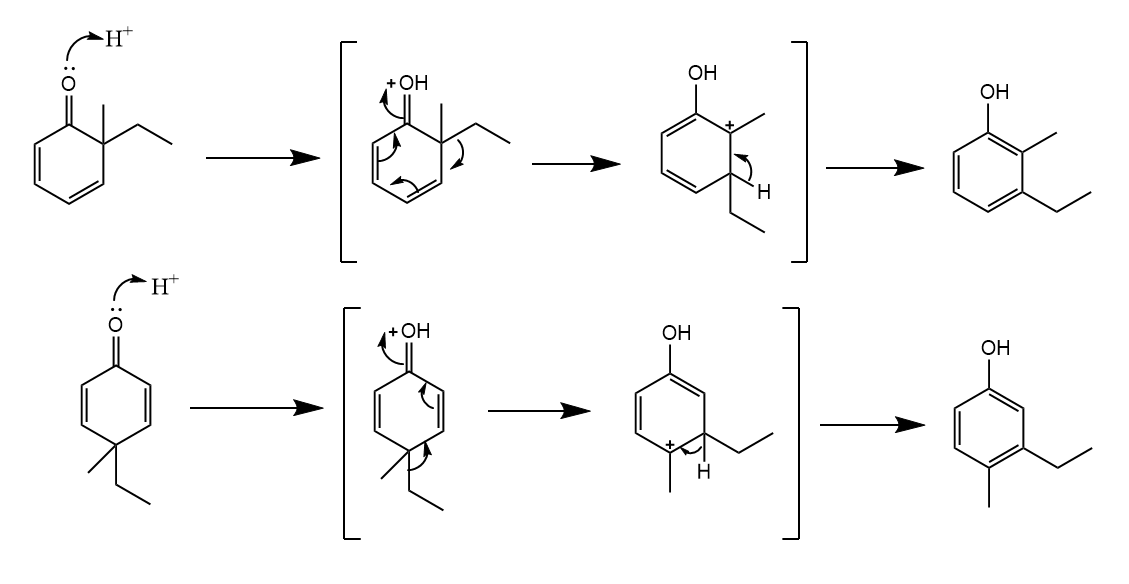
重排的驱动力在于实现芳构化,类似的醇也可以发生这样的重排,最后生成芳香烃。
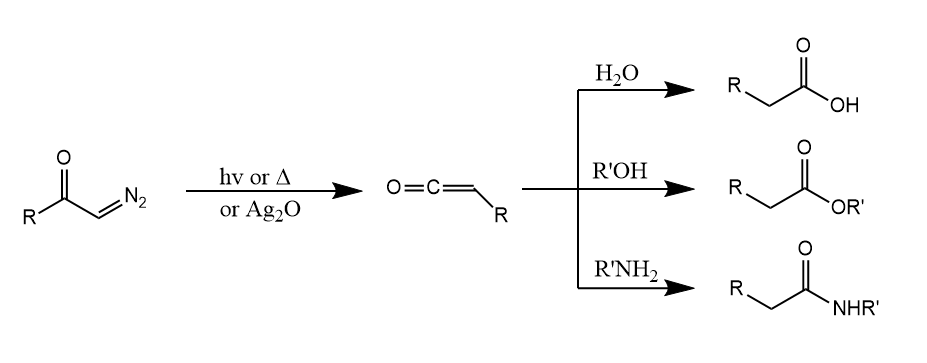
Wolff重排。α-重氮羰基化合物在光照或加热条件下,或在氧化银存在下失去一分子氮气,生成烯酮,并和亲核试剂发生后续反应。
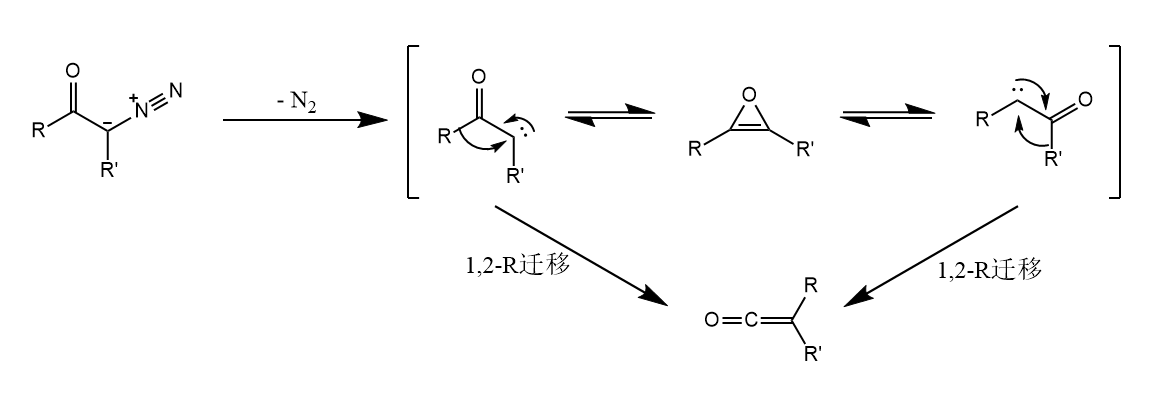
反应经历α-羰基卡宾中间体,1,2-烷基迁移后生成烯酮。
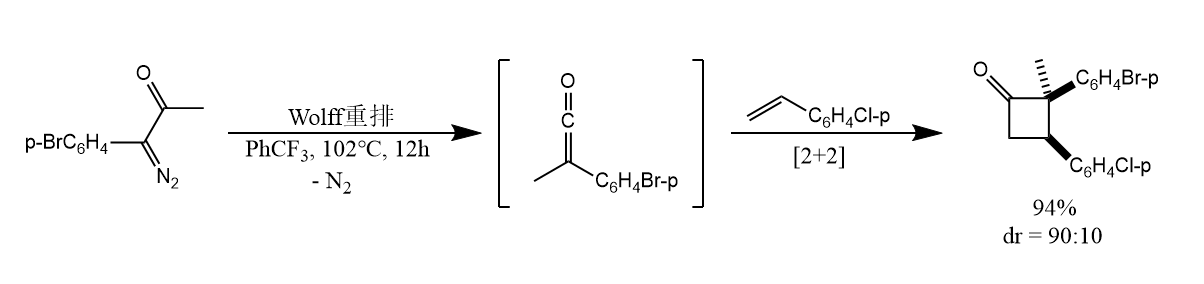
烯酮除了可以被亲核试剂捕获,也可以发生环加成反应,如:
Favorskii重排。α-卤代羰基化合物在碱性条件下重排生成羧酸。
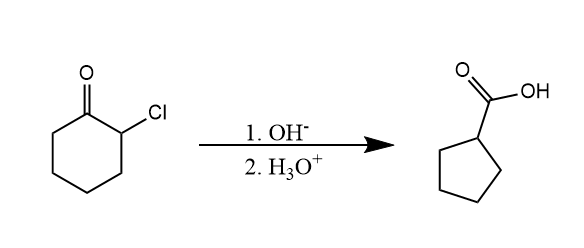
该反应发生的前体是底物能发生烯醇互变,羰基α-H有一定酸性,底物中有离去基团。
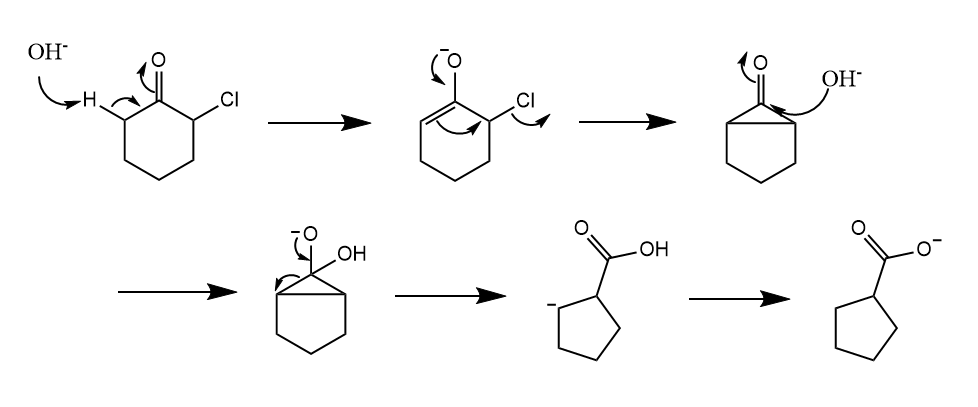
在烯醇负离子形成受抑制或无法形成时,可能发生类Favorskii重排。
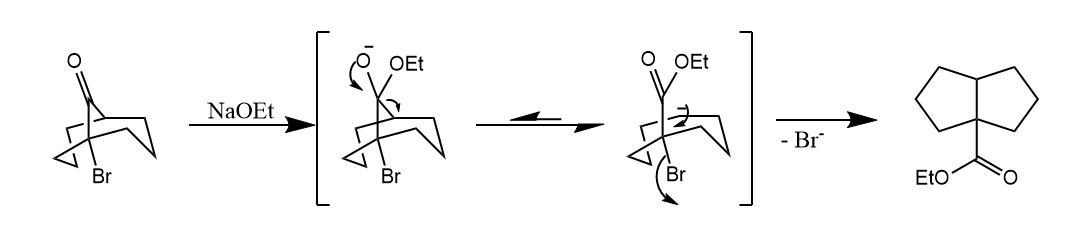
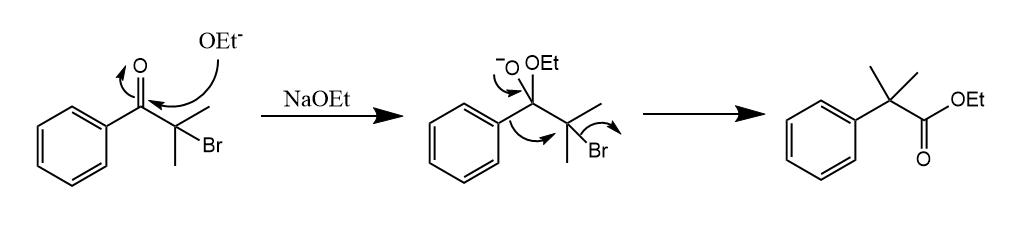
[2,3]-Wittig重排。在强碱条件下,烯丙基醚重排形成醇的反应,反应的驱动力是氧负离子的稳定性高于碳负离子。
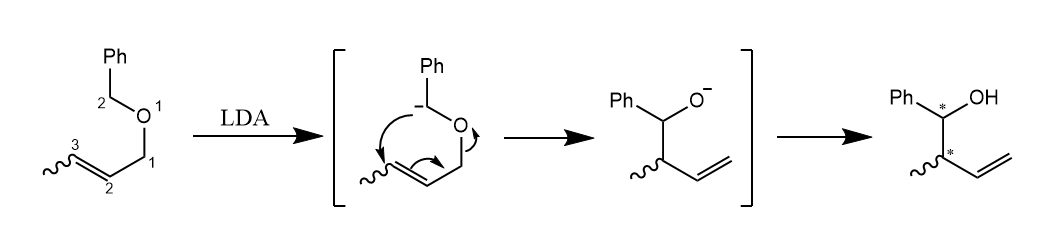
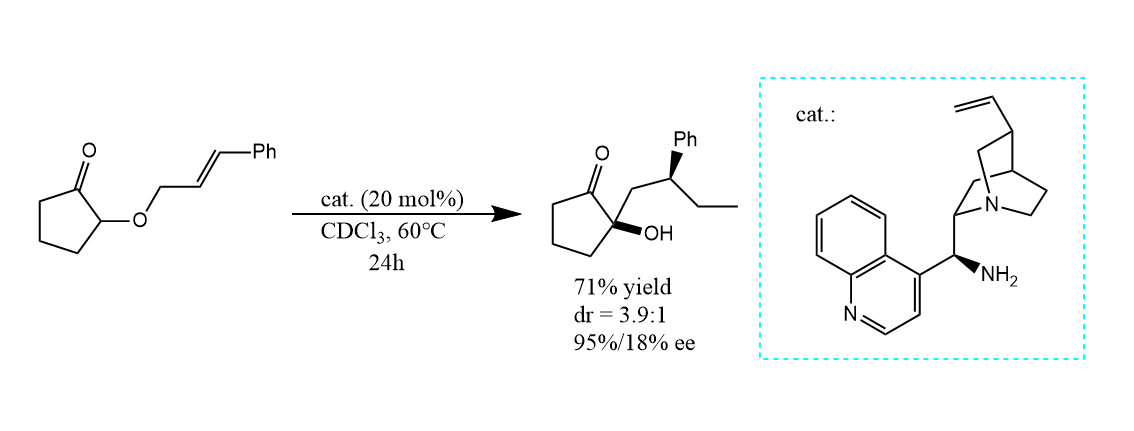
用手性的生物碱作催化剂,反应具有对映选择性:
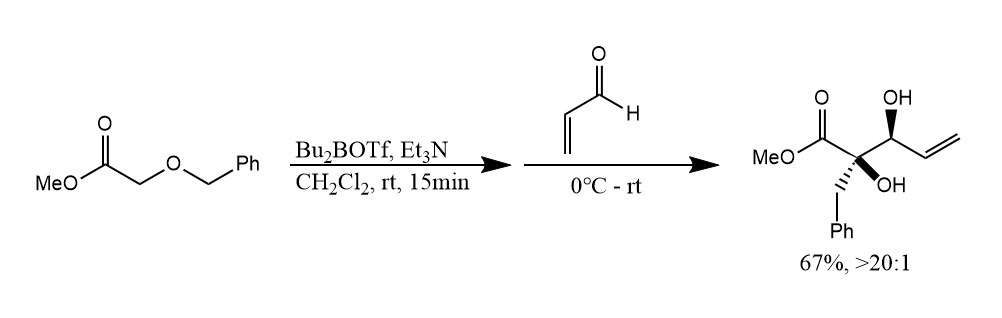
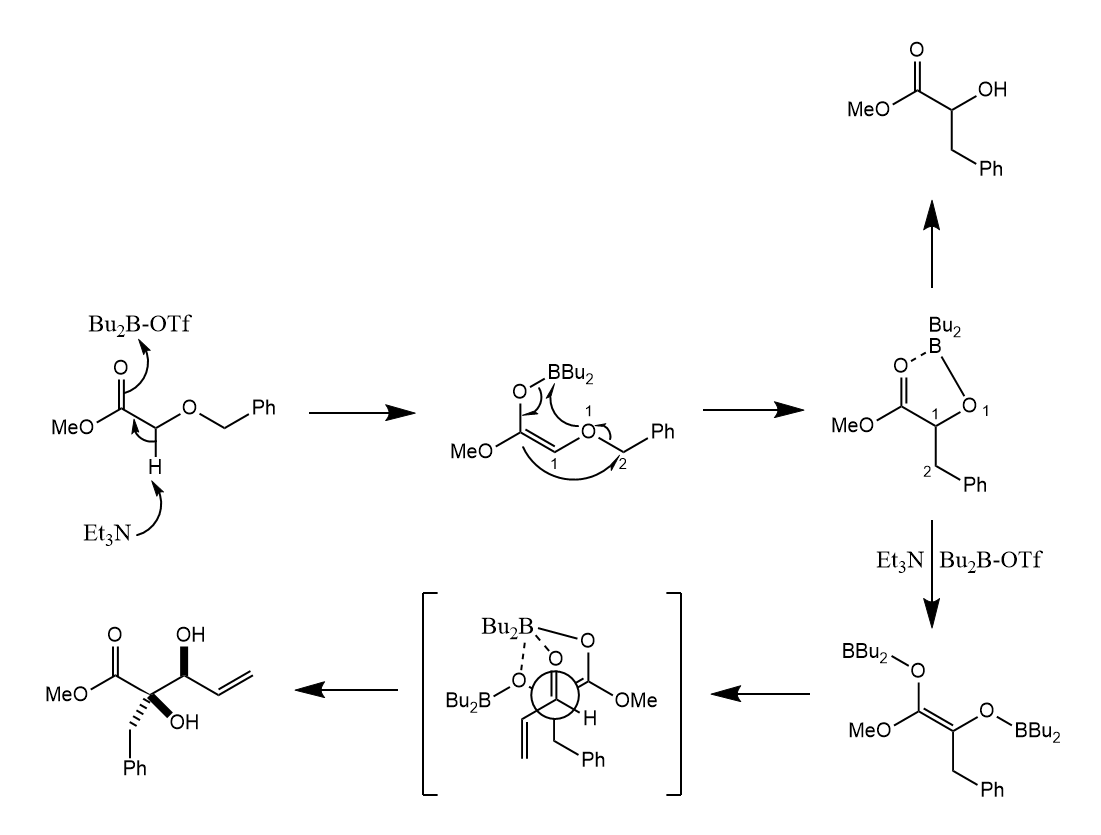
[1,2]-Wittig重排。反应经历自由基机理,苄醚在碱性条件下发生[1,2]-Wittig重排,继而被丙烯醛所捕获,反应具有非对映选择性。
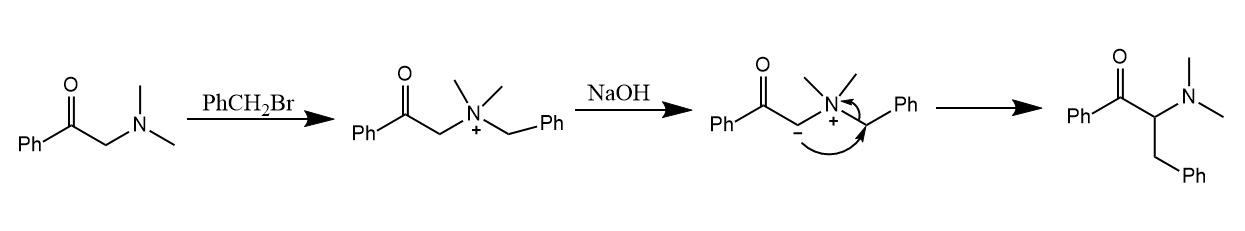
Stevens重排。季铵盐和锍盐在碱性条件下脱去α-H,生成的氮叶立德和硫叶立德可分别发生分子内重排,生成相应的叔胺和硫醚。
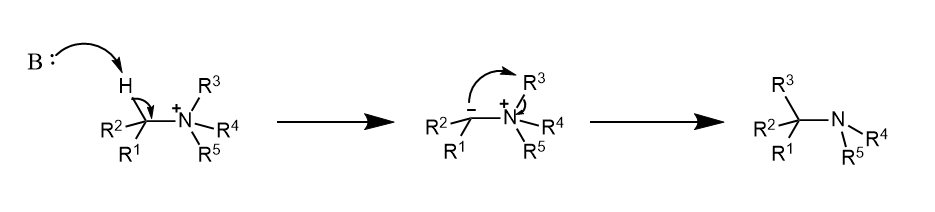
重排时更缺电子的基团更易受到进攻:
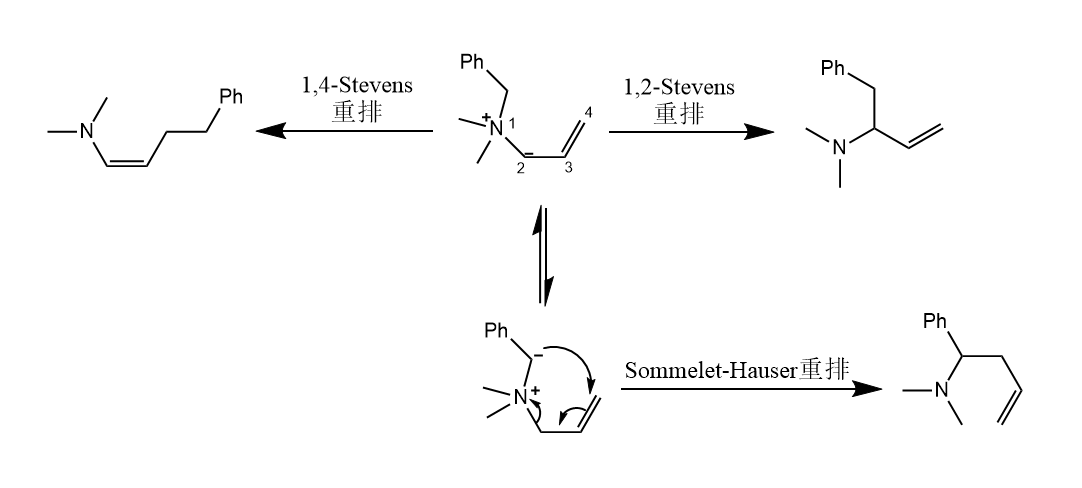
烯丙基胺季铵盐不仅能发生1,2-Stevens重排,还能发生1,4-Stevens重排发生烯胺,此外若氮原子上连有苄基,还可发生Sommelet-Hauser重排。
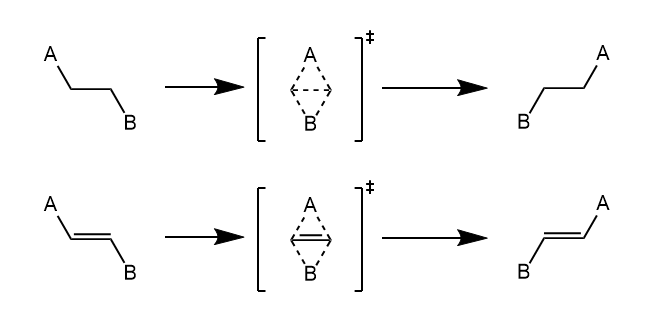
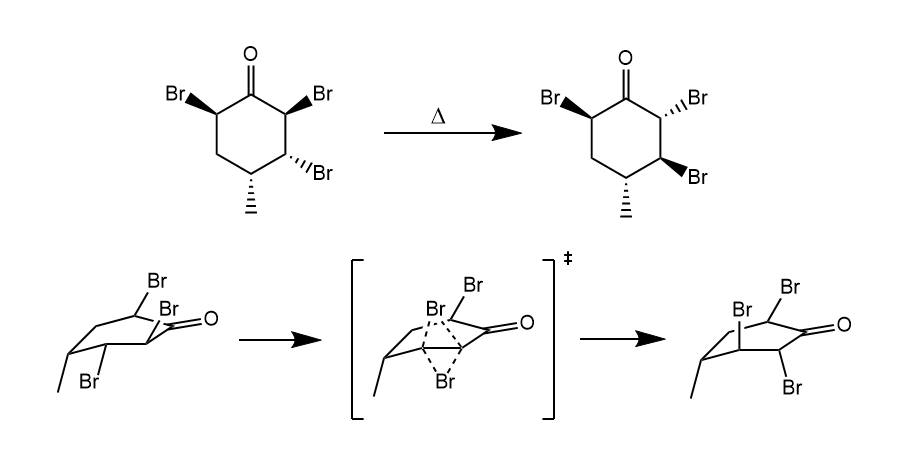
双向性重排反应(dyotropic rearrangement)。两个邻位的σ键同时迁移的反应,其中一种反应类型如下。
如下光学活性的三溴代环己酮在加热条件下会发生变旋作用。
9.2 重排到缺电子性氮原子上
当氮原子上连有电负性大的原子(X)时,$N-X$的共享电子对偏向X,氮原子就呈现一定缺电子性,因此可能接受其他基团的迁移。
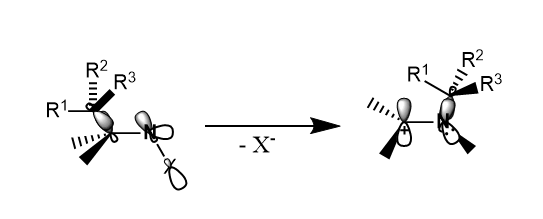
Stieglitz重排。N-卤代烃或羟胺在Lewis酸催化下发生重排,生成亚胺盐或亚胺。
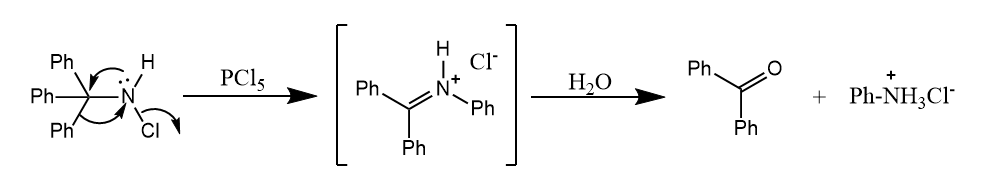
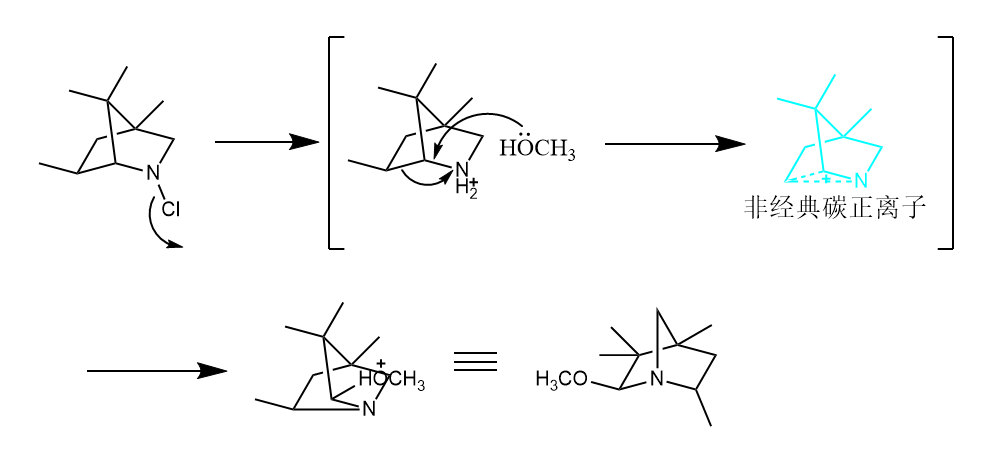
对于一些特定结构,无需Lewis催化也可以发生Stieglitz反应,如下所示的桥环氯胺化物,因为碳正离子可以被超共轭效应稳定。
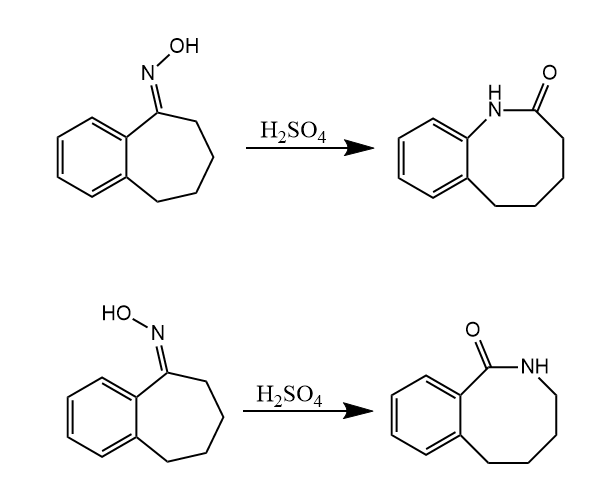
Beckmann重排。肟在质子酸或Lewis酸存在下重排生成酰胺。
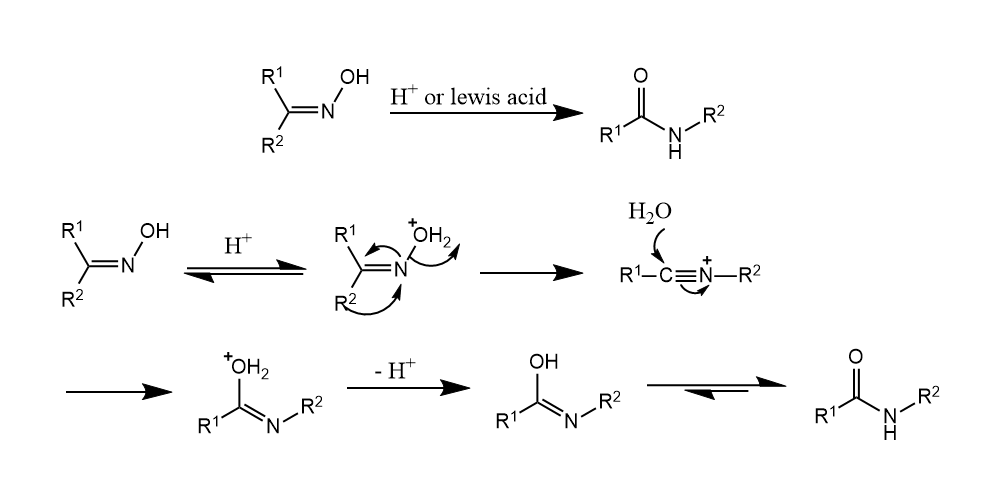
离去基团的离去和迁移基团的迁移是通过三元环过渡态协同进行的,因此Beckmann重排具有区域选择性,位于羟基反位的基团发生迁移。
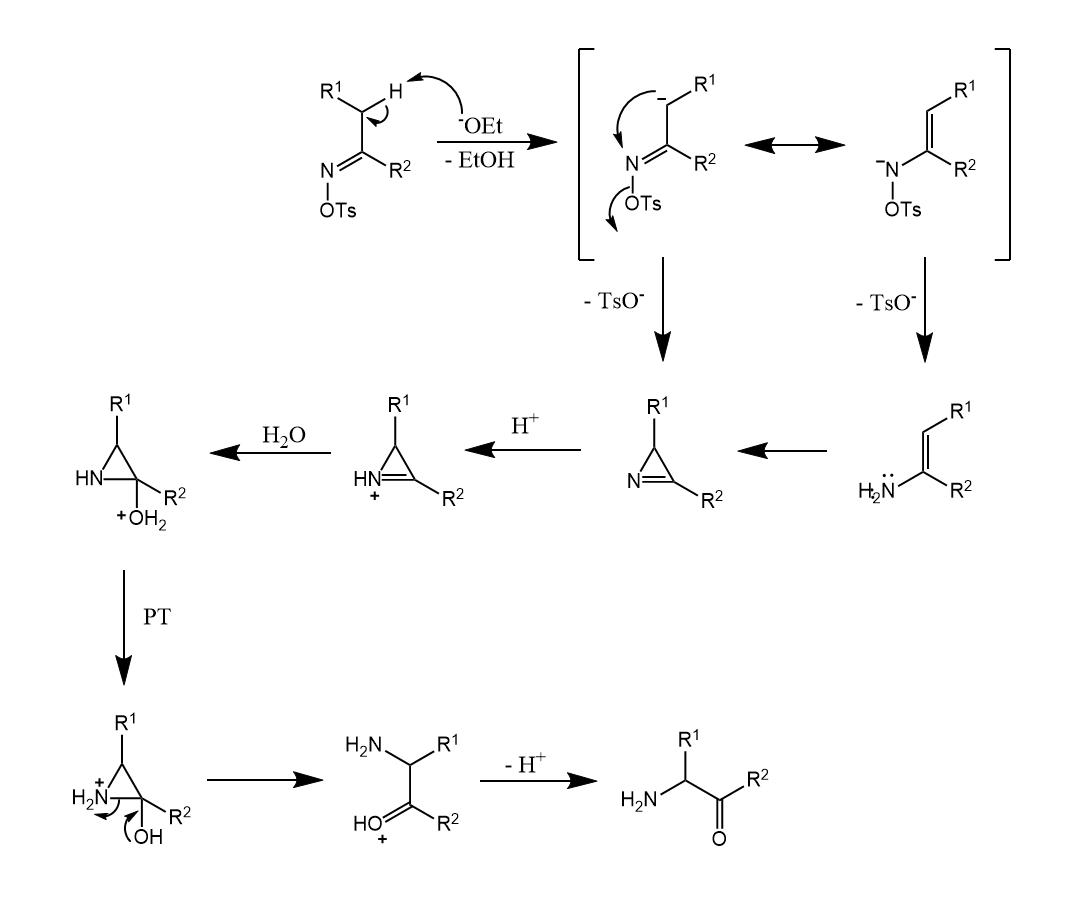
Neber重排。用强碱处理肟的对甲苯磺酸酯,再经乙酸和盐酸处理,得到α-氨基酮。
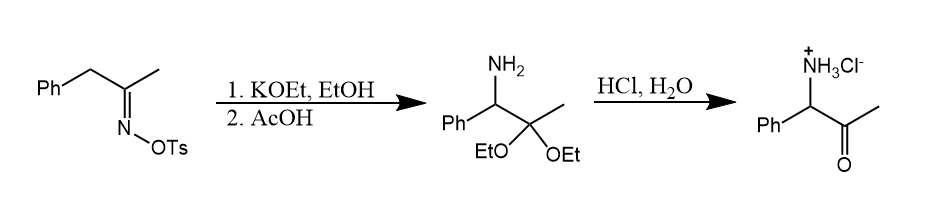
反应经历氮杂环丙烯中间体,水解后得到产物。
Hofmann重排。酰胺在溴的氢氧化钠水溶液中降解生成胺的反应,酰胺碳原子被氧化生成二氧化碳。
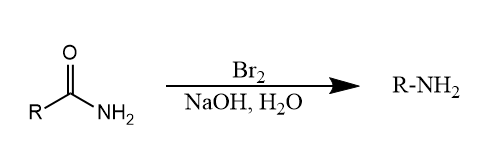
Hofmann重排经历异氰酸酯中间体,同样还有几个反应经历同样的中间体,它们实际上也都大同小异,将在下面依次介绍。
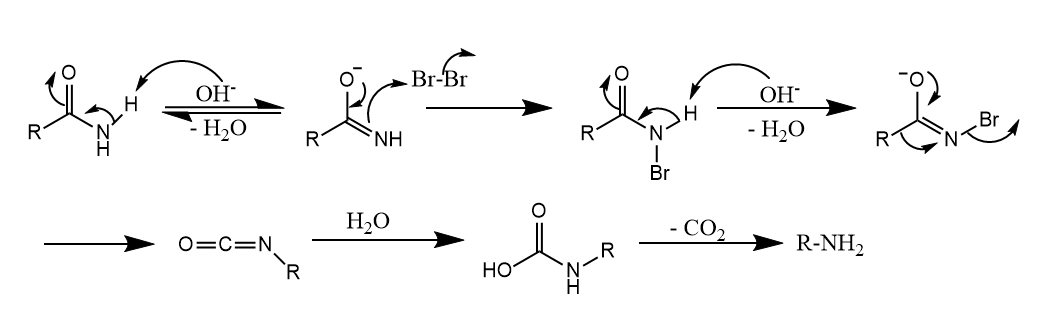
Hofmann重排可以使用其他亲电试剂反应,如$Pb(OAc)_4$或有机高价碘试剂,反应在不同溶剂中也会生成不同产物。
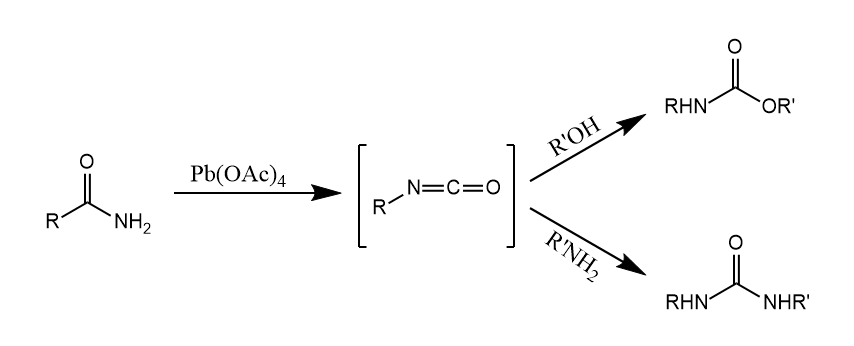
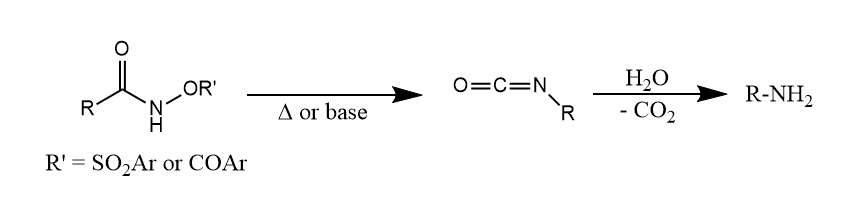
Lossen重排。当伯酰胺的氮原子上连有酰氧基或磺酰氧基等吸电子基时,可以在加热或碱性条件下发生类似Hofmann重排的反应,生成异氰酸酯。
Curtius重排。酰基叠氮热解或光解生成异氰酸酯,同时放出氮气。
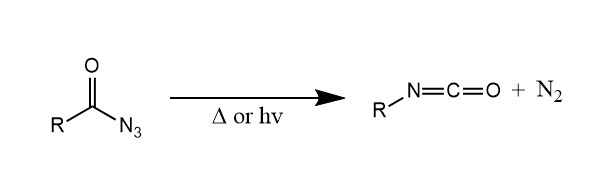
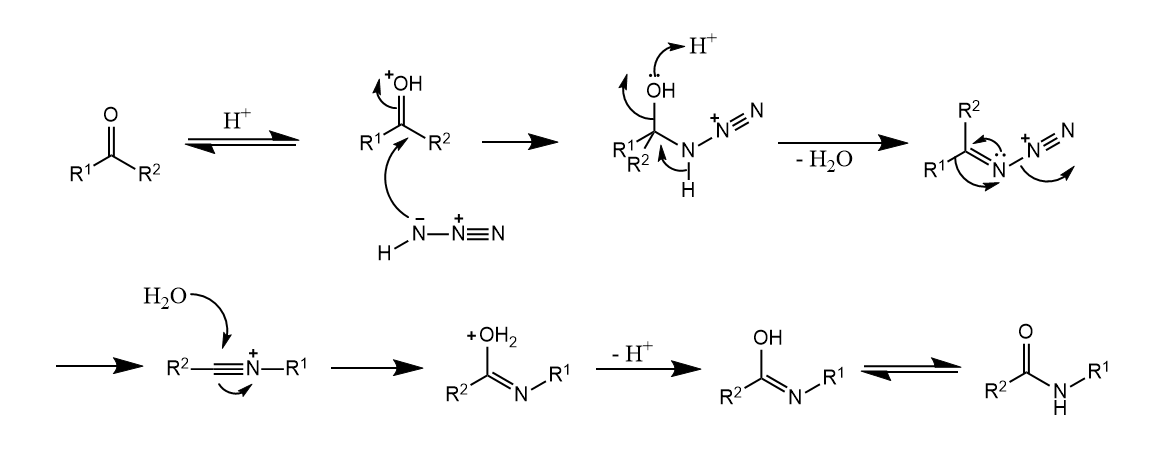
Schmidt重排。在质子酸或Lewis酸存在下,羧酸于叠氮酸作用,放出电器,生成少一个碳的伯胺。
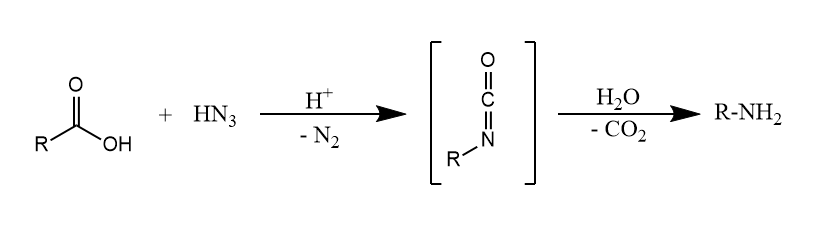
Schmidt重排与Curtius重排非常类似,不过醛酮也可以发生Schmidt重排。
9.3 重排到缺电子性氧原子上
与9.2节相似,如果氧上连有大电负性原子,则氧原子会显缺电子性,可以接受R基的迁移。同样列举相关反应。
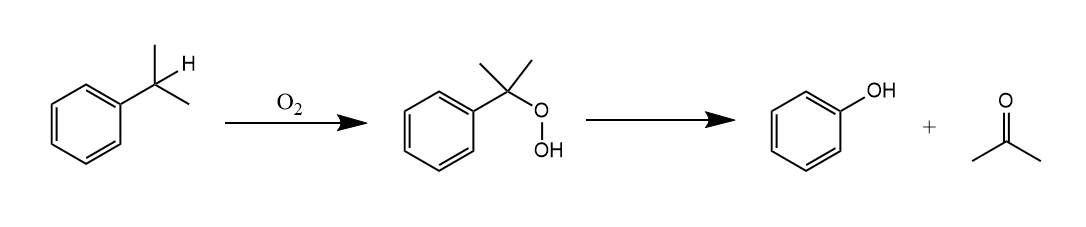
Hock重排。当碳氢化合物上有过氧或过氧氢基团时,在酸性条件下烷基或芳基能迁移到缺电子性氧原子上。
Baeyer-Villiger氧化。酮被过氧酸氧化生成酯的反应。反应具有区域选择性,与Wagner-Meerwein重排的迁移能力相同,即芳基优于烷基、叔碳优于仲碳优于伯碳。
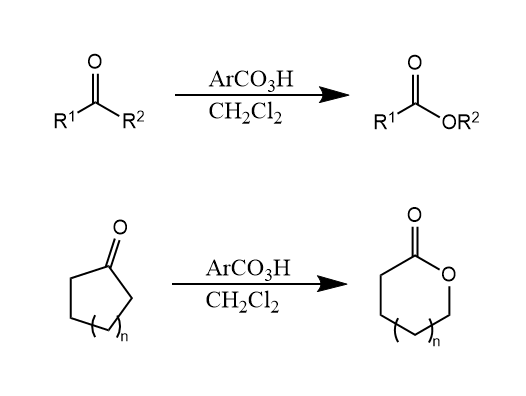
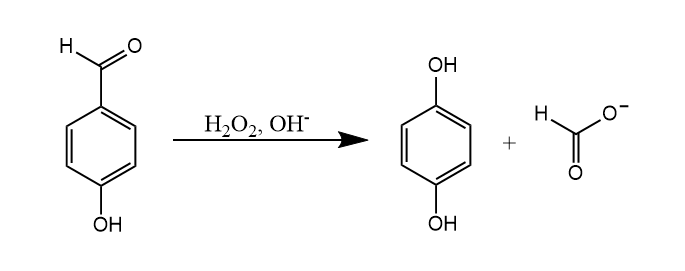
Dakin氧化。对羟基苯甲醛在碱和过氧化氢作用下生成对苯二酚和甲酸钠,该反应可以看作是Baeyer-Villiger反应的一个特例,因此其机理和影响因素都与Baeyer-Villiger反应很类似。
总结
本章是较为重要的一章,列举了大量不同类型的重排反应,许多反应都可以看作是一个系列的不同例子,因此理解总的反应性原理更为重要。
好多图 :(