《中级有机化学》章末总结11
第十一章讨论还原反应,还原反应的种类和范围都很广,但是其机理较复杂,很多反应还没有被很好的研究。
第11章 还原反应
11.1 常见有机还原反应的机理类型
一般氧化还原反应的机理都要比离子型反应和自由基反应复杂的多,所以许多反应的机理,人们对其了解甚少。
一些常见的有机还原反应的机理主要包括:
- 单电子转移(SET)。常见于碱金属和其他一些单电子还原剂(金属还原剂和$SmI_2$等),其途径主要有两种,一是电子先转移到底物中,形成自由基负离子,然后负离子质子化,形成中性自由基,接着自由基再得电子产生负离子,最后再加氢还原;二是在形成自由基负离子后继续得电子,形成双负离子,最后一起质子化。
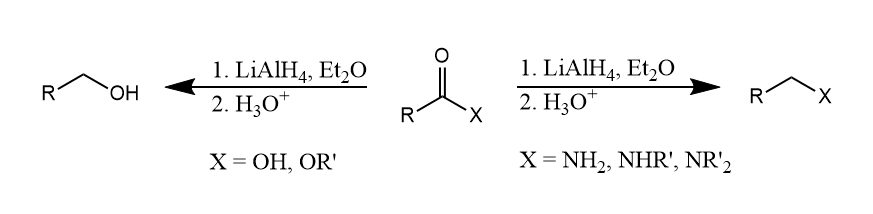
- 亲核加成和亲核取代机理。这一类机理主要见于$NaBH_4, LiAlH_4$等金属氢化物反应中,负氢离子作为亲核试剂发生还原反应。
- 催化氢化和氢解机理。烯烃、炔烃、醛、酮等有机物的不饱和键在催化剂促进下加氢转化的反应,可以分为非均相催化和均相催化两种。除此之外还有催化转移氢化(CTH),即把一些有机化合物的氢转移给底物分子。
- 其他机理。还有一些还原反应通过其他机理进行,如Wolff-Kishner-黄鸣龙还原等。
11.2 催化氢化
烯烃在钯、镍或铂等金属催化剂的存在下,与氢加成生成烷烃,称为催化氢化。
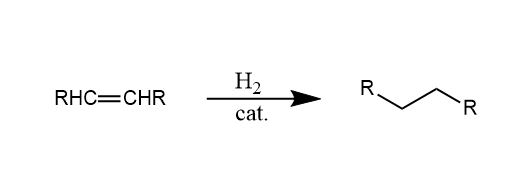
对于此类非均相催化反应,催化加氢过程在催化剂的表面进行,所以催化剂的表面积越大,反应效率越高。常用的Raney镍催化剂是由铝镍合金经碱处理后所形成的骨架镍,常用的钯碳催化剂则是将钯吸附在活性炭上,都是扩大催化剂表面积的方法。
炔烃也可以催化氢化生成烯烃或烷烃,降低催化剂的活性,如Lindlar催化剂是Pd粉附着在碳酸钙上并加入抑制剂$Pb(OAc)_2$制成的部分“中毒”催化剂。类似的还有Rosenmund催化剂,它是Pd粉附着在硫酸钡上并加入少量喹啉等抑制剂制成的。使用该催化剂可以把酰氯还原为醛,称为Rosenmund还原反应。
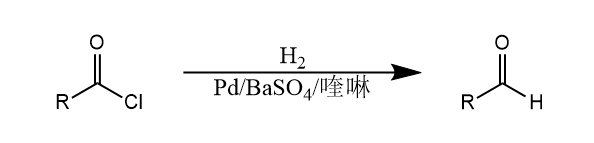
催化氢化常用于将含氮化合物还原为胺,是制备胺的经典方法。
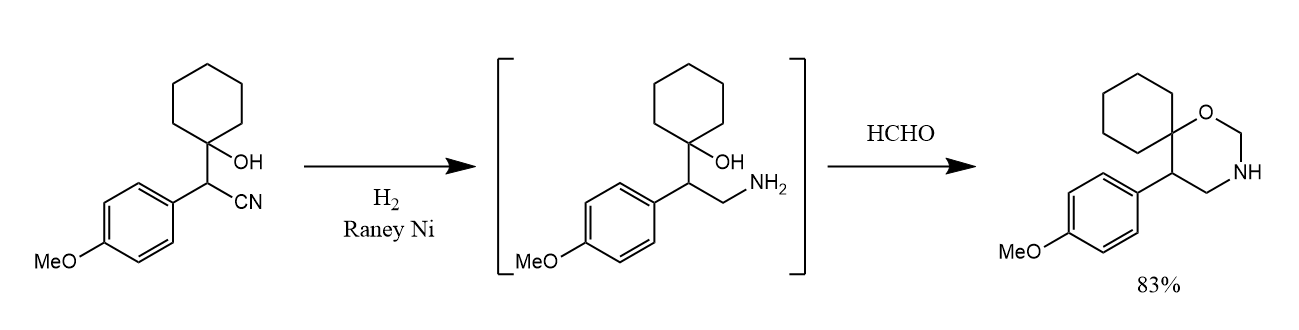
均相催化氢化反应常用的催化剂为Rh,Ru,Ir等贵金属与适当的有机配体形成的配合物,使用手性配体形成手性催化剂还可以实现不对称氢化反应。
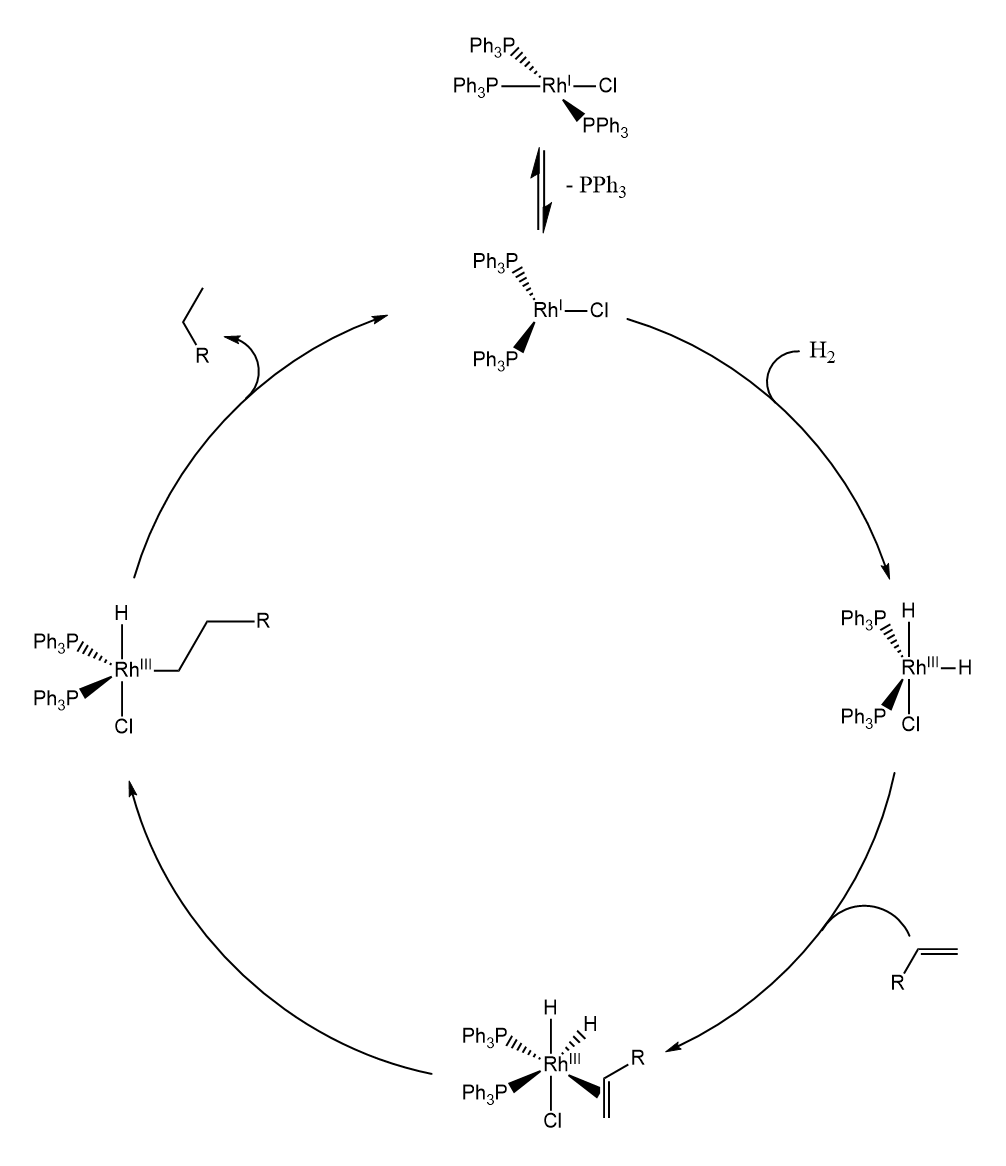
Wilkinson催化剂是英国化学家Wilkinson在1966年发现的,其为氯化三(三苯基膦)合铑(Ⅰ)$[RhCl(PPh_3)_3]$。Wilkinson催化剂可以用于烯烃的催化氢化,机理如下:
均相催化氢化亦可用于$C=N$键的加氢还原,例如在Rivastigmine的合成中就利用了手性催化剂进行不对称还原胺化。
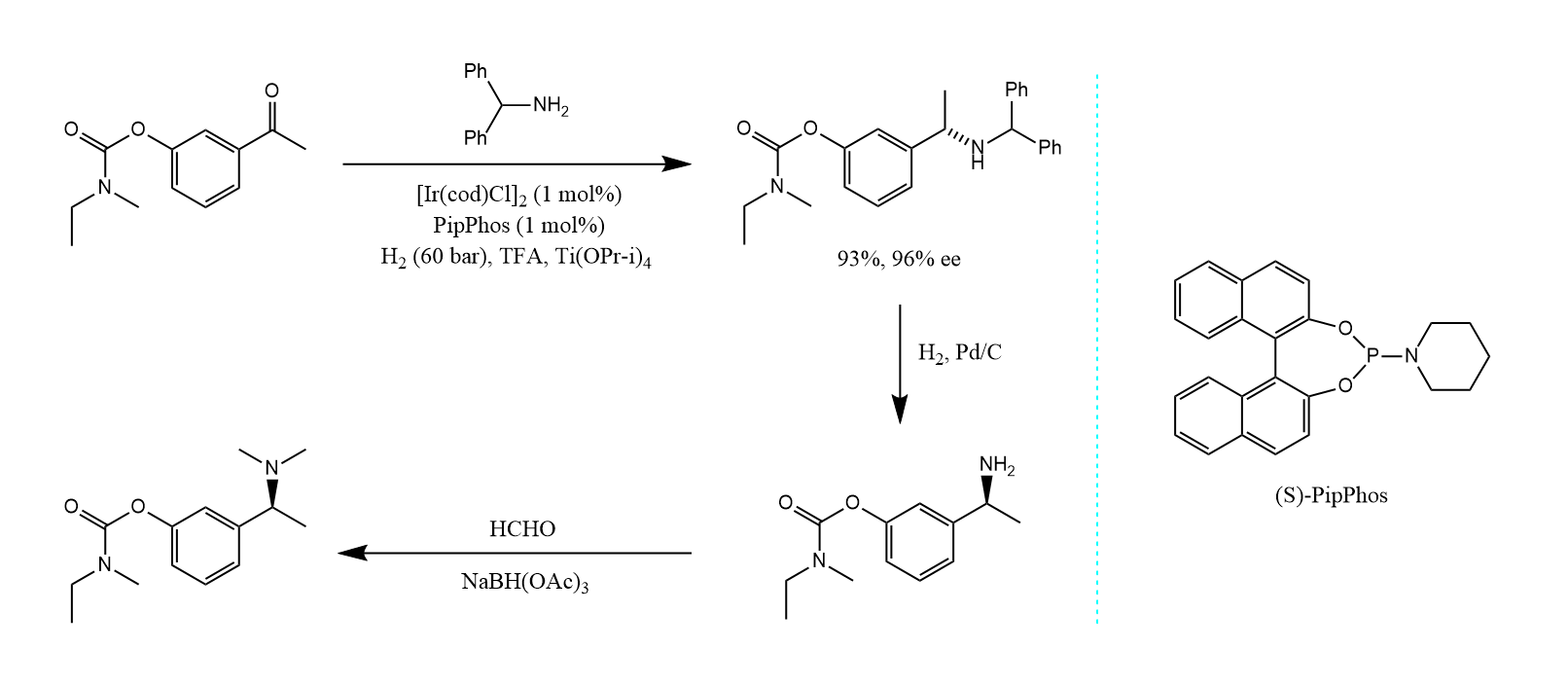
催化转移氢化(CTH)是有机合成中一种有效的还原手段。它采用含氢的多原子分子作氢源(又称氢供体),反应中氢从氢供体转移给反应产物(即氢受体)。
一个经典例子是Meerwein-Ponndorf还原,该反应使用异丙醇作为氢供体还原酮。
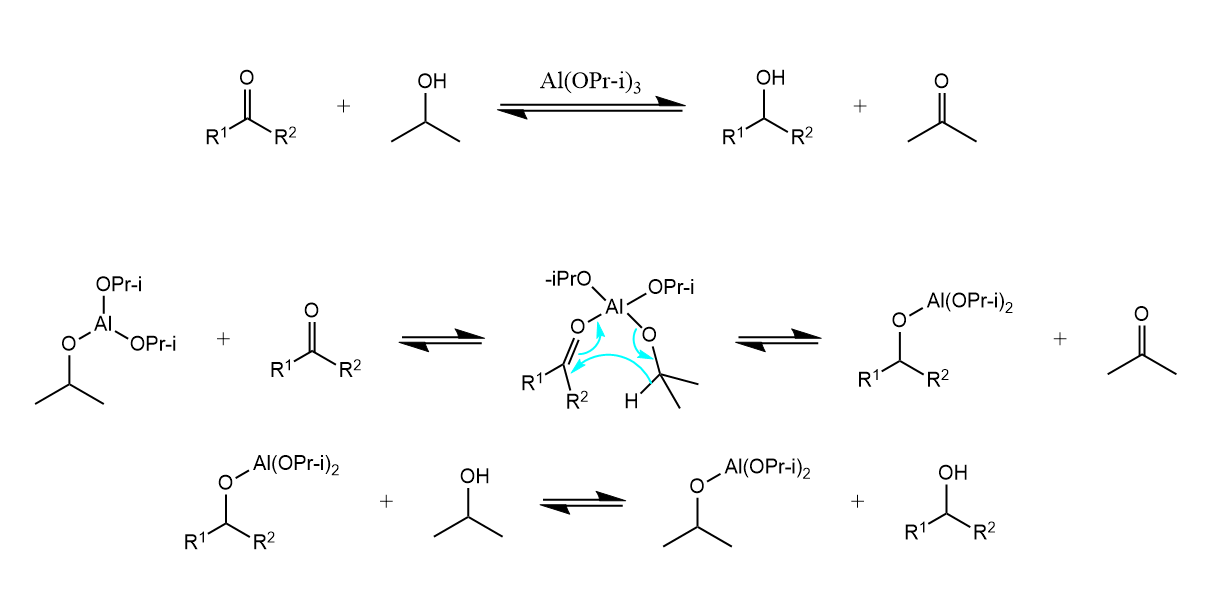
反应具有很好的选择性,碳碳双键、酯基、硝基合活泼的卤素一般不被此法还原。
烯烃和炔烃也可以进行催化转移氢化。
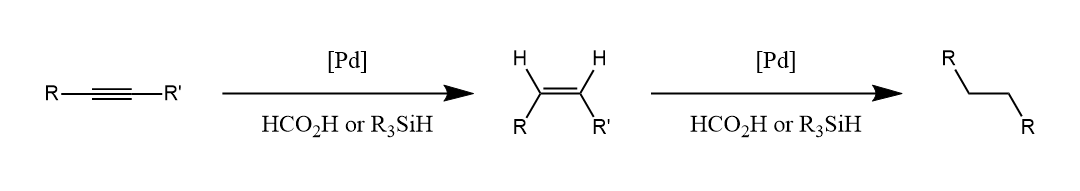
含$C-X$和$C-S$键的化合物在氢供体存在下也可发生催化氢解。
11.3 用金属还原剂还原
溶解金属还原通常经历一个由金属表面或溶解金属的电子转移到反应物的单电子转移过程,溶剂作为质子源提供质子,常用的溶剂有醇、乙酸、氨和胺等。
用碱金属还原的反应如Birch还原,碱金属在液氨和醇的混合液中可以将芳烃还原为非共轭的1,4-环己二烯化合物。
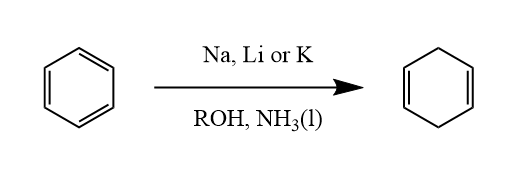
反应涉及单电子转移历程,首先生成自由基负离子,质子化后再得电子获得负离子。双键的位置取决于取代基的电子效应,吸电子基会生成少取代烯烃,给电子基则是生成多取代烯烃。
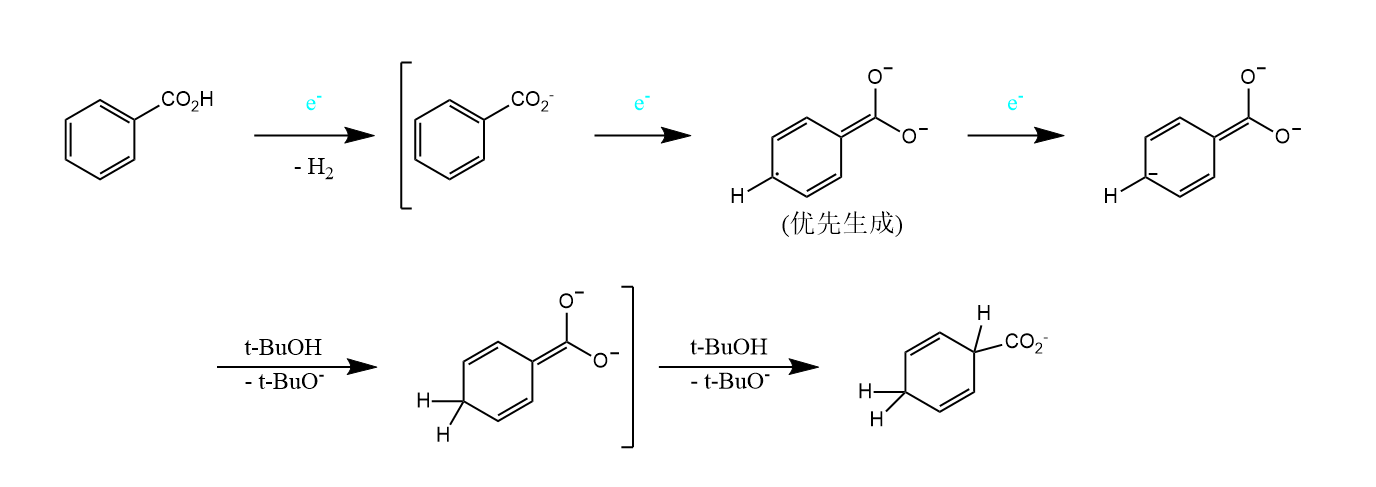
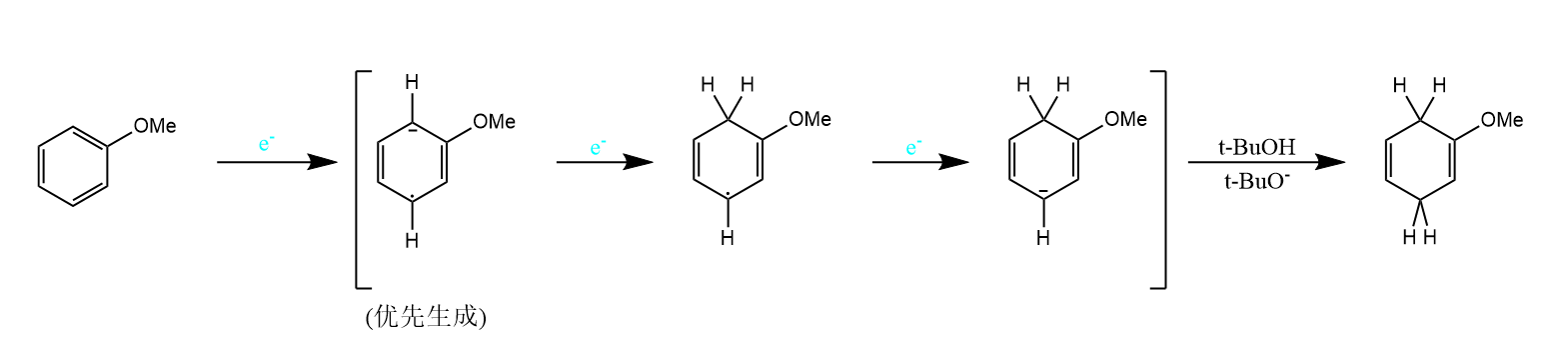
杂环化合物亦可发生Birch还原,吡啶、喹啉和异喹啉等电子密度低的芳环优先被还原。
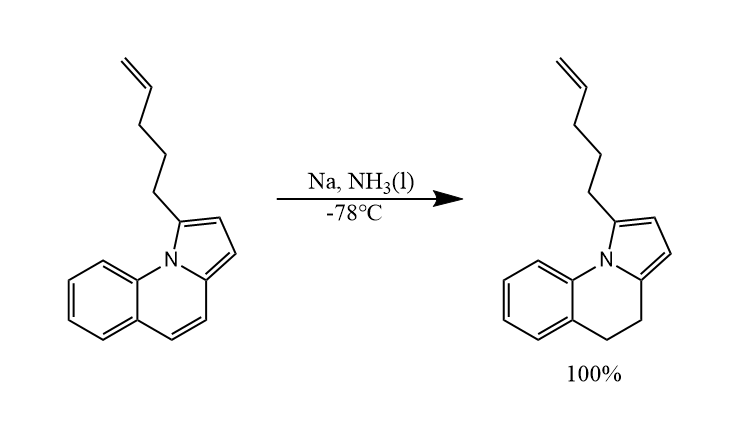
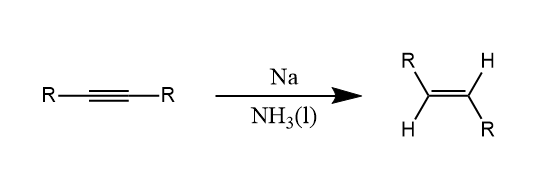
炔烃也可以被溶解金属还原,反应主要生成反式烯烃,即获得热力学产物。
溶解金属可以在质子性溶剂中将醛、酮或酯还原成相应的醇,该反应称为Bouveault-Blanc还原,反应机理与Birch还原异曲同工。
当羰基的α-碳上有取代基时,反应具有良好的立体选择性,优先生成热力学稳定的反式产物。
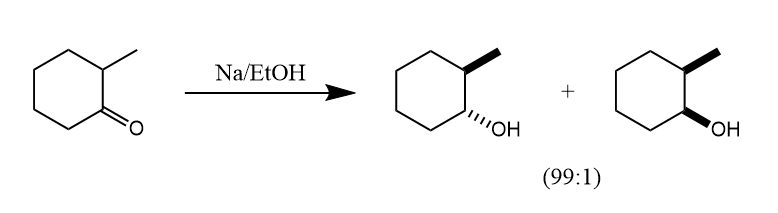
在类似条件下,溶解金属可将酯还原为伯醇,将酰胺还原为胺。
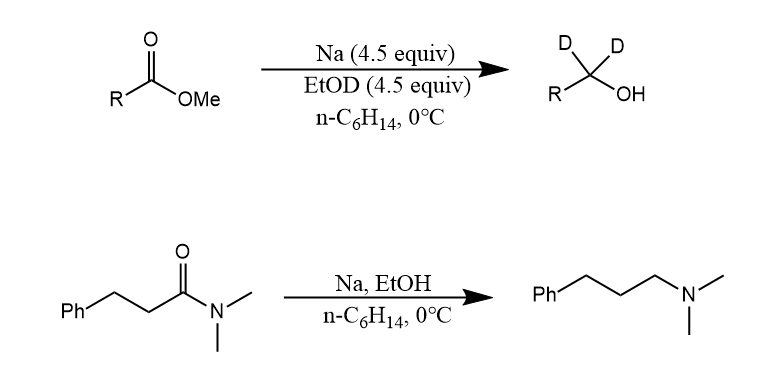
在浓盐酸或干燥的氯化氢存在下,锌汞齐可将醛酮的羰基还原为亚甲基,称为Clemmensen还原。
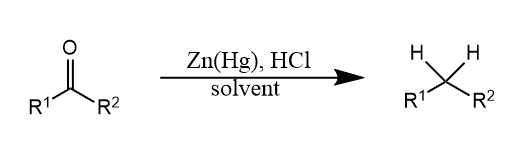
活化的锌能够在醇溶剂中将炔烃立体选择性地还原为顺式烯烃,$Zn(Cu)$还原剂是已经商业化的试剂。
上述两个反应的机理尚无确定解释,此处略去。
镁作为还原剂,可使醛酮发生双分子还原偶联,生成邻二醇。反应经历一个$Mg^{2+}$稳定的双自由基中间体。
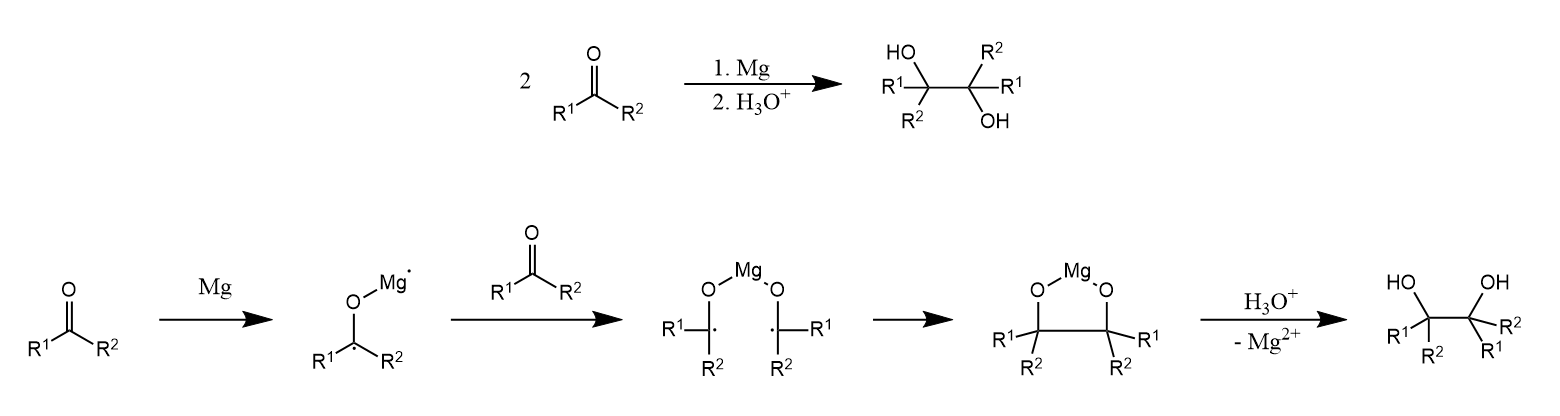
11.4 用负氢还原剂还原
常用的硼氢化合物是硼氢化钠和硼氢化钾,主要用于还原醛、酮。虽然氢负离子是一个很强的碱,但硼氢化钠的氢由于与硼原子结合而降低了它的反应活性,故可在醇类溶剂中使用。
使用硼氢化钠还原$\alpha,\beta-$不饱和醛酮时,其选择性不高,如果将硼氢化钠与$CeCl_3$联合使用,可获得1,2-还原的选择性,称为Luche还原。
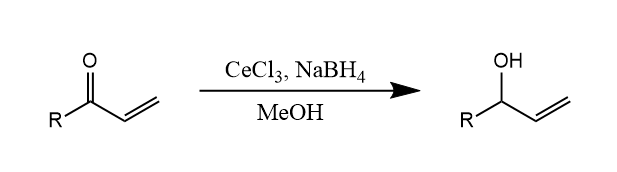
在该反应中,$CeCl_3$的作用有二,一是其与硼氢化钠结合,形成烷氧基硼氢化物,形成更硬的还原剂,更容易与羰基反应;二是其与醇配位增强了醇的酸性,提高了羰基碳的亲电性。
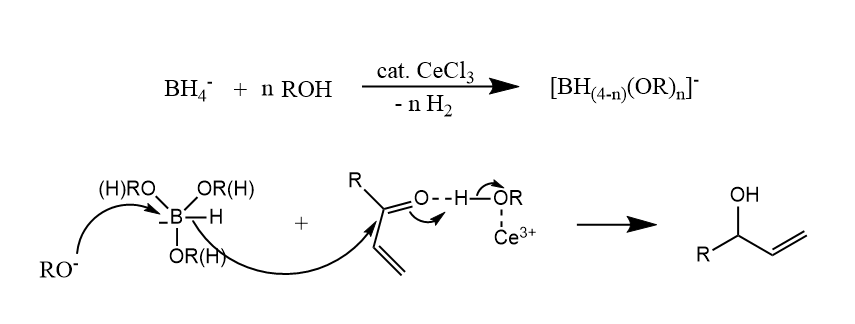
Luche还原的一个有趣的特点是,其对酮羰基的选择性高于对醛羰基的选择性。这个特点的原因可能是因为酮羰基相对更“硬”。
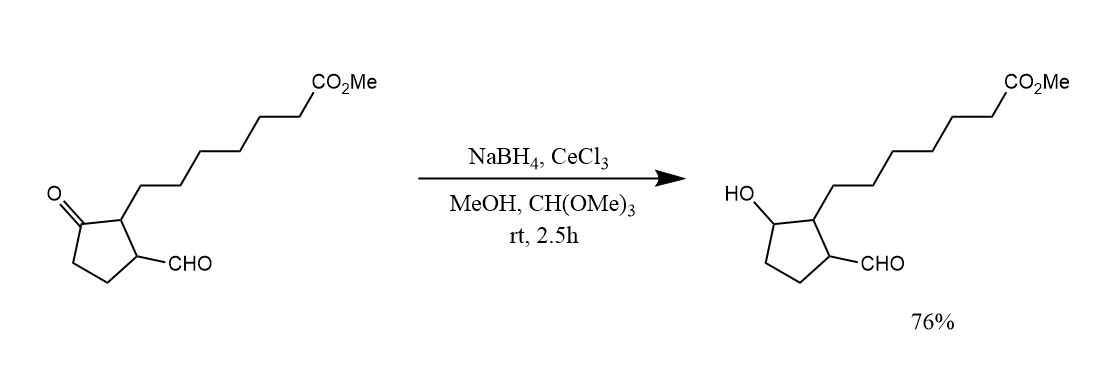
硼氢化钠对亚胺和亚胺盐的还原与羰基的还原类似,$NaBH_3CN$是常用的一种还原剂。例如下面这个例子。
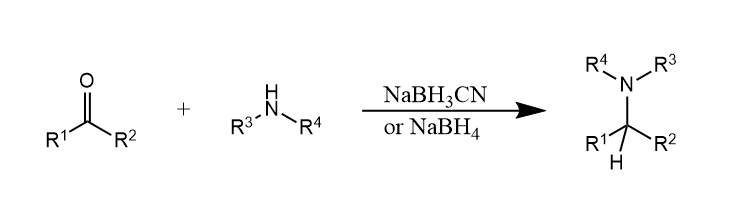
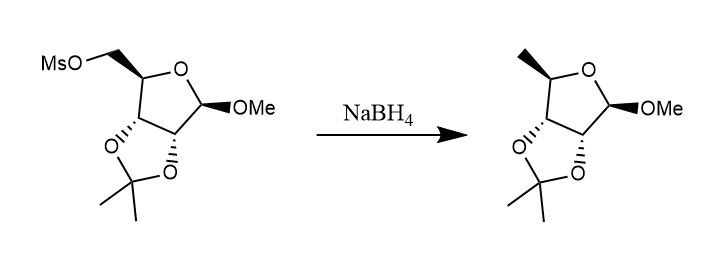
硼氢化钠可以还原卤化物和磺酸酯,反应机理可看作简单的$S_N2$反应。
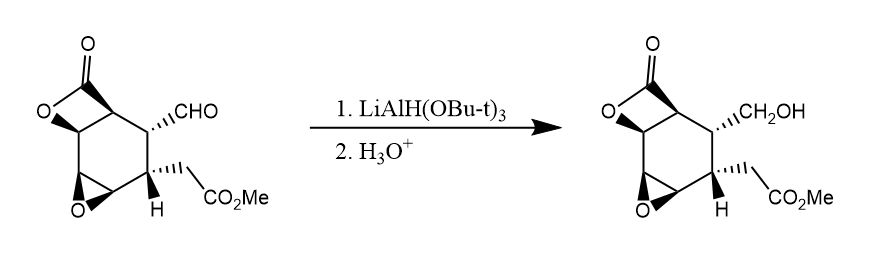
氢化铝锂及类似的烷基氢化铝等试剂的还原能力很强,也因而往往缺乏选择性。用烷氧基取代其中的氢,降低还原能力可以提高选择性。如三叔丁氧基氢化铝锂是一种温和的还原剂,可将醛酮还原,而酯基、环氧、卤素等不受影响。
用手性配体修饰氢化铝锂后,得到手性还原剂,而且能够对映选择性地还原酮。常用的手性配体如BINAL。
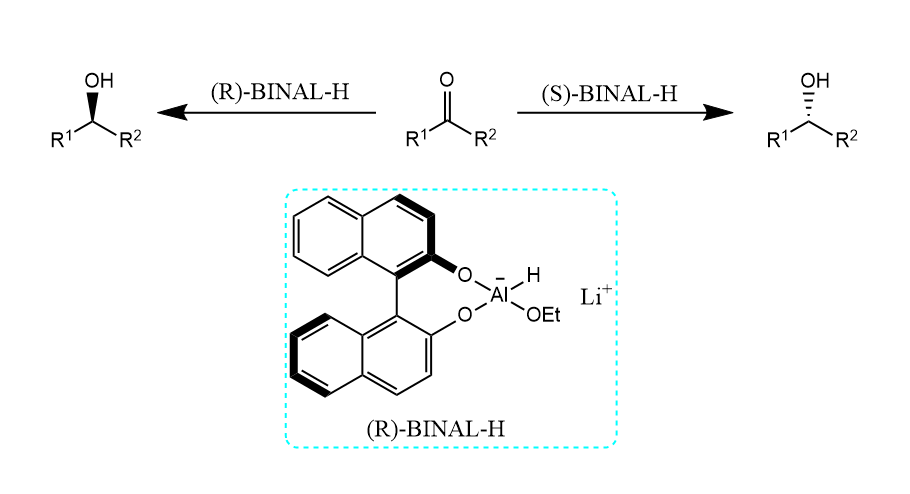
( 具体的构象分析就不写了,主要是我不想画图了。 )
氢化铝锂可将羧酸和酯还原为醇,将酰胺还原为胺。
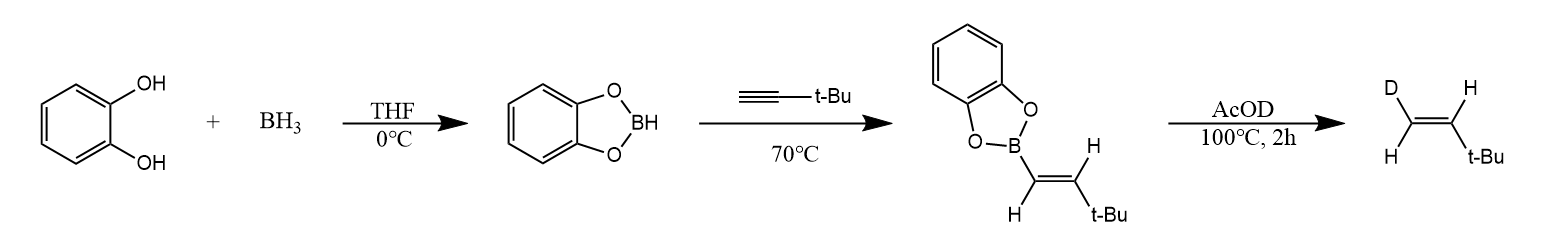
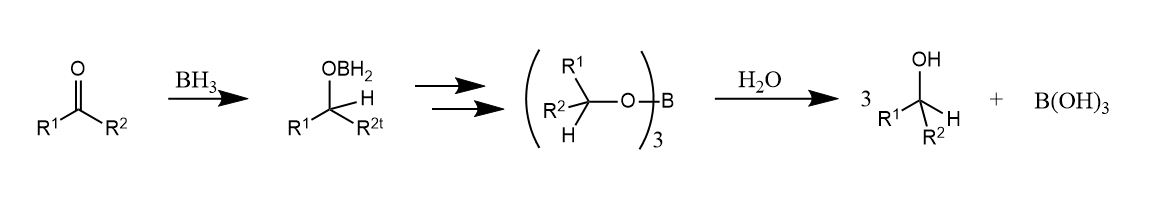
硼烷类化合物可以通过硼氢化反应将碳碳重键和碳氧重键等还原,烯烃与硼烷发生硼氢化反应,反应结果相当于烯烃的顺式加氢。
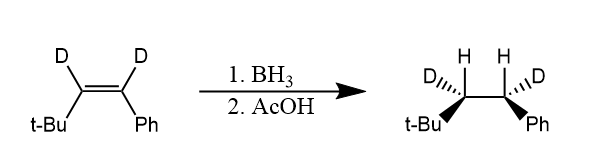
反应经历一个四元环过渡态,随后生成烷基硼烷产物,烷基硼烷对水、醇和无机酸都不敏感,但遇到羧酸容易发生质子解反应。
炔烃可以发生相同的反应,为避免二次硼氢化,常用高位阻的二烷基硼烷作为硼氢化试剂。对于一般的炔烃,反应的选择性一般,对于末端炔烃则具有较好的区域选择性。
醛和酮的硼氢化还原同样经历四元环过渡态生成烷氧基硼,水解即得醇。
一些 B-烷基取代的 9-BBN 衍生物(如 9-BBN-蒎烯加合物)能够将醛、酮还原为相应的醇,称为Midland还原。
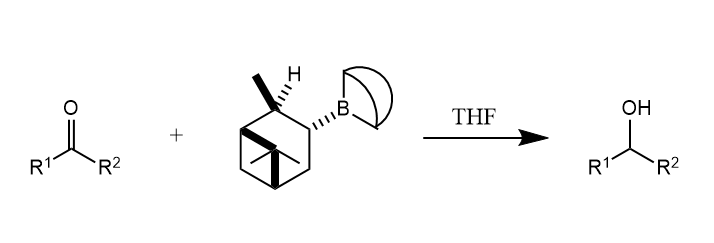
反应可能涉及船式过渡态,热力学有利的过渡态结构是体积较大的取代基处于平键的结构,由此可以预测产物构型。
羧酸、酰胺被硼烷还原为伯醇、胺,机理都与上述反应相似。
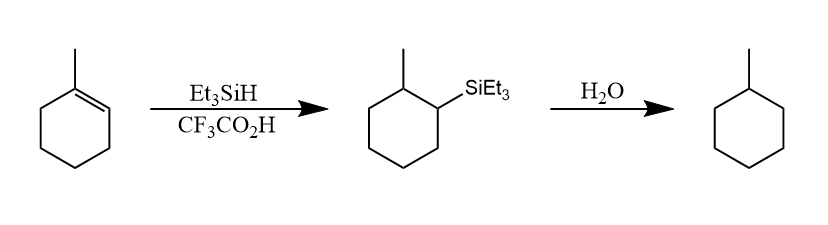
硅氢化反应是还原$C=C,C=O$等的重要方式,反应生成反马氏规则的烷基硅烷/硅醚产物,后经水解即得还原产物
11.5 用其他有机还原剂还原
除了上文提到的几种方法外,还有一些比较难简单归类的还原反应,下面依次介绍。
醛酮在高沸点溶剂中与肼和氢氧化钾一起加热反应,羰基被还原为亚甲基,此反应称为Wolff-Kishner-黄鸣龙还原。
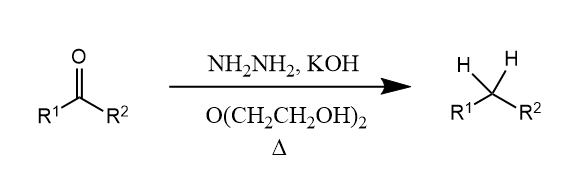
甲酸及其盐(如甲酸铵)是常用的有机还原剂,醛或酮与甲酸铵一起加热生成伯胺,该反应称为Leuckart反应。
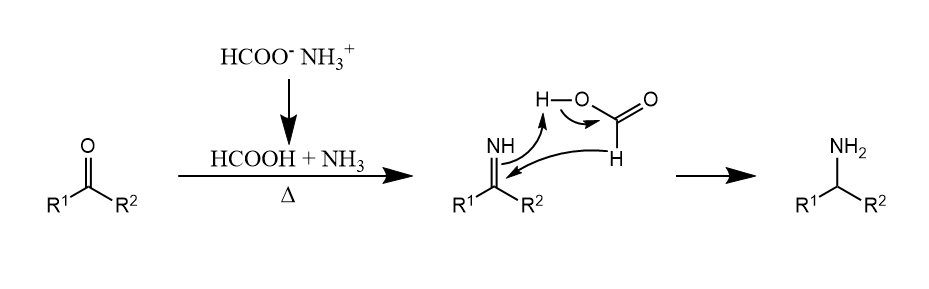
该反应可以应用于还原胺化中,称为Leuckart-Wallach反应。
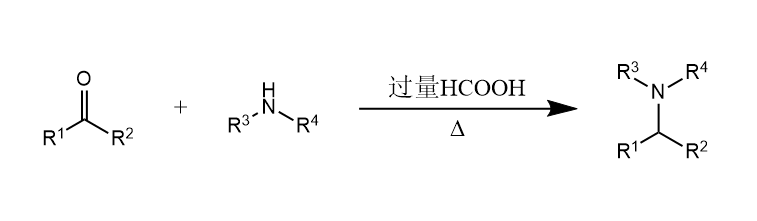
11.6 歧化反应
在强碱条件下,无α-H的醛可发生歧化反应,生成等量的醇和酸,该反应称为Cannizzaro反应。
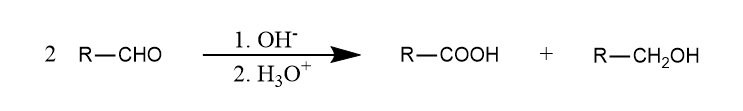
一般认为Cannizzaro反应过程涉及负氢转移,若使用两种不同的无α-H的醛,则还原性更强的醛作为氢供体把负氢转移出去。
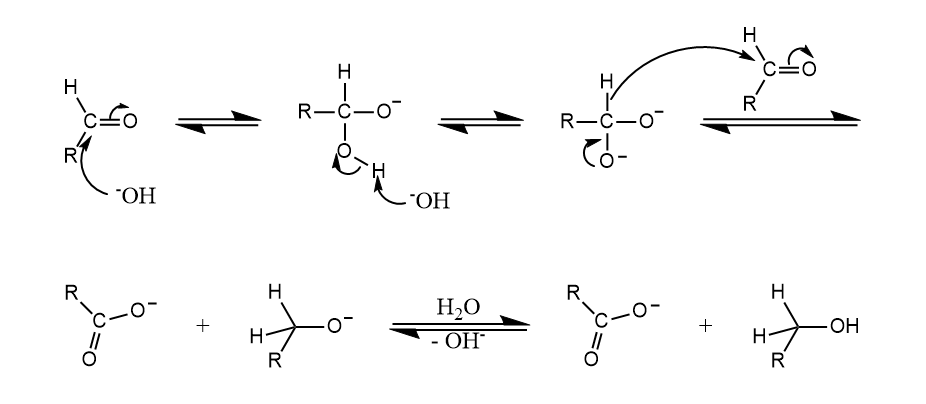
经典的Cannizzaro反应在碱催化下进行,但Lewis酸也可促进这一转化。
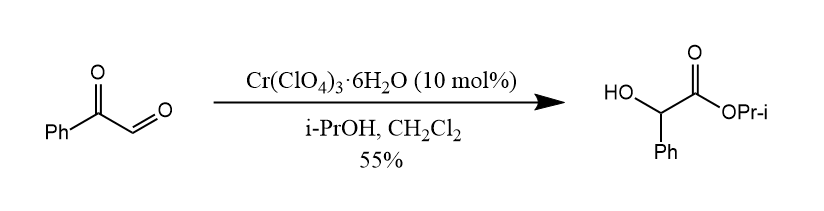
W. Tischenko发现醛在烷氧基铝催化下发生歧化反应,并最后缩合得到酯,此反应称为Tischenko反应。
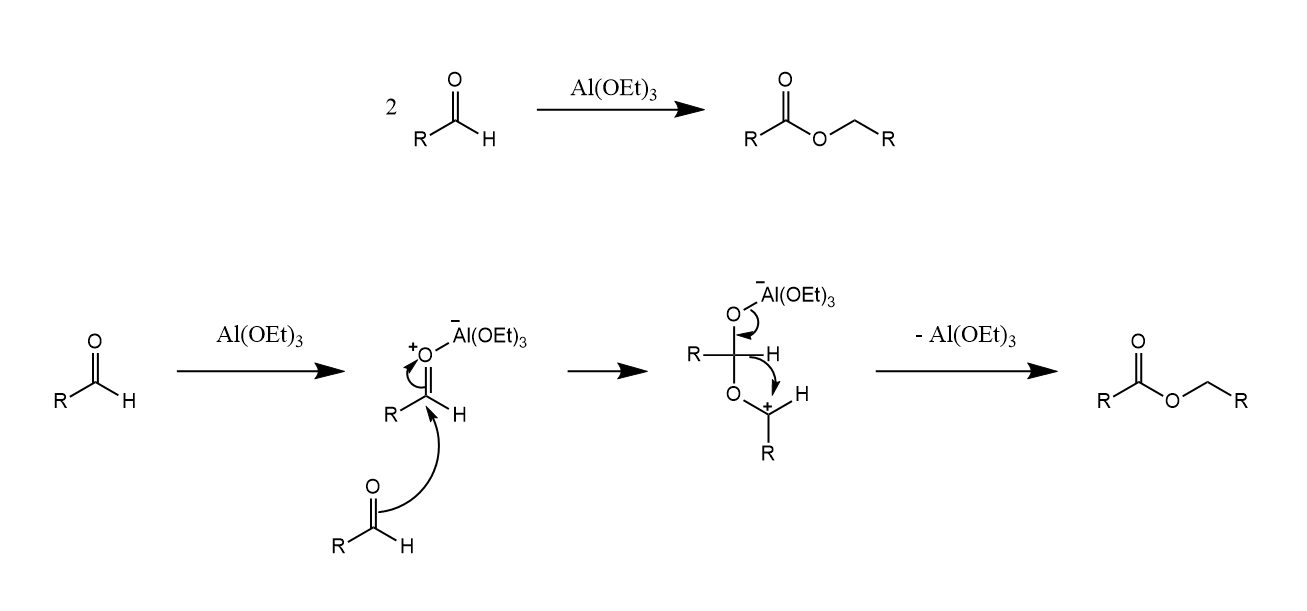
Tischenko反应与Cannizzaro反应的机理类似,经历一个负氢转移的过程完成歧化,反应的底物可以是芳香醛,也可以是脂肪醛。
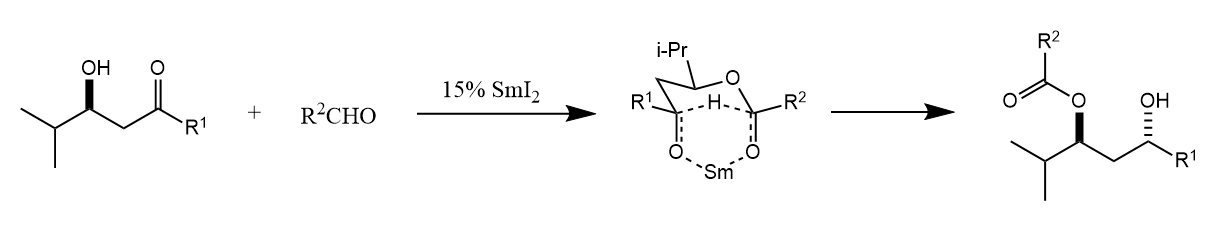
Tischenko反应使用的烷氧基铝催化剂可能会参与反应得到副产物,因此在1990年,D. A. Evans改进了Tischenko反应,使用$SmI_2$催化,手性β-羟基酮与另一分子醛反应,生成anti-1,3-二醇类化合物,称为Evans-Tischenko反应。
总结
本章为还原反应,其机理有不少都较为复杂,因此在基础有机里涉及较少,此处可以作为补充。